- Йога начинающим видео
- Хулахуп танец видео
- Смотреть моя тренировка видео
- Видео тренировки александра емельяненко
- Как правильно крутить обруч на бедрах видео
- Тренировки в кудо видео
- Тренировки рой джонса видео
- Йога онлайн смотреть видео
- Тренировки костя дзю видео
- Видео тренировки роя джонса
- Видео спинальной
- Айенгар йога видео
- Йога для женщин на видео
- Правильно крутить обруч видео
- Плиометрические отжимания видео
- Новости

Управление Здравоохранения Евпаторийского городского совета (С)2011
67 гостей
Ендометріоз: що нового? Новації тактики і терапії
Plus est in re, quam in existimatione mentis.
(Велике значення має реальний стан справ,
ніж уявлення про нього).
Існує кілька теорій, що пояснюють патогенез ЕМ. Ембріональні і дизонтогенетические теорії базуються на тому, що ЕМ розвивається з зміщених ділянок зародкового матеріалу, з якого в процесі ембріогенезу формується зокрема ендометрій. Теорії ендометріального походження свідчать про розвиток ЕМ з елементів ендометрію, зміщених в товщу стінки матки, яєчників, маткової труби, інших відділів статевого апарату і за його межі. Проростанню ендометрія в товщу стінки сприяють порушення балансу статевих гормонів, хірургічні втручання та інші фактори. Хірургічна травма ендометрія може викликати попадання елементів слизової оболонки порожнини матки з потоком крові і лімфою в інші органи і тканини. Метастатичні теорії походження ЕМ доводять розвиток останнього в результаті метаплазії ембріональної очеревини або целомического епітелію. Теорія ретроградної менструації полягає в тому, що під час менструації відбувається закид менструальної крові з клітинами ендометрія в маткові труби і черевну порожнину, де за певних умов клітини можуть почати циклічно функціонувати. Відповідно до теорії целомической метаплазміі, ділянки ЕМ виникають внаслідок переродження мезотелия яєчників. Не виключена також роль теорії ембріональних залишків: ембріональні клітини парамезонефріческого протоки в прямокишково-піхвової області можуть диференціюватися в ендометріоїдних тканини.
Незважаючи на велику кількість теорій, багато питань патогенезу ЕМ не з'ясовані дотепер. Однак визначені пускові механізми захворювання: стрес, неправильне харчування, общесоматические захворювання, внутрішньоматкові втручання, порушення функцій залоз внутрішньої секреції, інфекції статевих органів.
Факторами ризику ЕМ є укорочений (менше 21 дня) і подовжений (понад 28 днів) менструальний цикл, подовжений період менструації (6 днів і більше), раннє її початок, наявність ЕМ у матері і сестер, вживання алкогольних напоїв один раз і більше на тиждень , використання вагінальних тампонів, відсутність пологів або одні пологи в анамнезі, часті аборти, часті статеві зв'язки з різними партнерами, важка фізична праця і заняття спортом під час менструацій, а також все те, що ускладнює вільне виділення менструальної крові з порожнини матки і може сприяти її попаданню через маткові труби в черевну порожнину.
У ряді робіт останніх років обговорюються додаткові фактори ризику розвитку ЕМ (З.М. Дубосарська, 2006): порушення функції підшлункової залози і печінки, запальні захворювання внутрішніх геніталій, що призводять до ановуляції або недостатності функції жовтого тіла, внутрішньоклітинні патогени (вірусні, хламідійні, Уреаплазменная ), хірургічні втручання на матці, в тому числі кесарів розтин, консервативна міомектомія і операції на придатках, стресові ситуації, анаболізму гормональних препаратів, погіршення еколо ня ситуації.
Істинну частоту захворювання ЕМ визначити досить важко, тому що прийнято вважати, що остаточний діагноз встановлюється лише при лапароскопії або лапаротомії. У різних дослідженнях частота ЕМ коливається від 1 до 50%, в залежності від контингенту обстежених.
За локалізацією ЕМ ділять на дві групи: генітальний (96%) і екстрагенітальний (4%). Генітальний ЕМ, в свою чергу, поділяють на внутрішній і зовнішній. До внутрішнього генитальному відносять ЕМ матки (аденоміоз) і фаллопієвих труб, до зовнішнього генитальному - ЕМ яєчників, піхви, зовнішніх статевих органів, промежини, вагінальної частини шийки матки, круглих маткових зв'язок, ретроцервікальний ЕМ і ін.
Екстрагенітальний ЕМ проявляється наявністю патологічного процесу в кишечнику, брижі, сальнику, сечовому міхурі, пупку, паховій каналі, кінцівках, легких, післяопераційних рубцях і інших органах.
За глибиною проникнення в міометрій розрізняють чотири ступені поширення дифузної форми ЕМ матки (аденоміозу):
- I ступінь - проростання ендометріозу на невелику глибину;
- II ступінь - поширення процесу до середини товщини міометрія;
- III ступінь - залучення в патологічний процес всієї стінки матки;
- IV ступінь - залучення в процес парієтальної очеревини і сусідніх органів.
Гістологічне будова ЕМ характеризується поєднанням залозистого ендометріоподобние епітелію і цитогенной строми. Характерною гістологічною особливістю ЕМ є відсутність навколо нього сполучнотканинною капсули, унаслідок чого можна знайти здатність до инфильтрирующему проникаючого росту в навколишні органи і тканини з деструкцією останніх (за рахунок ферментативної активності ендометрія). В області перешийка і в стінці тіла матки ЕМ може мати дифузний характер, але частіше його осередки спостерігаються в вигляді вузлів або кістозних утворень, які зазвичай розвиваються в яєчниках, рідше - в післяопераційних рубцях, стінках піхви, вульви, в області пупка. Зрідка спостерігаються кістозні форми ЕМ матки, маткових труб, в легенях, нирках і стінці кишки.
Макроскопічно ЕМ може мати форму вузлів, інфільтратів без чітких контурів або кістозних утворень, наповнених геморагічної або густий коричневої ( «шоколадної») рідиною. Розміри вузлів варіюють від величини просяного зерна до декількох сантиметрів у діаметрі. На розрізі в вузлах видно порожнини у вигляді осередків або щілин, заповнених рідиною вищевказаного характеру. Консистенція вузлів щільна внаслідок розвитку навколо вогнищ і гнізд ендометріоїдних тканини інфільтративно-рубцевих змін через проникнення в тканини менструальноподібні кров'яних виділень, протеолітичних і ліполітичних ферментів, що виділяються вогнищами ЕМ, а також продуктів деструкції тканин, що утворюються в зоні активного ЕМ.
Важливою особливістю ЕМ є можливість вростання в будь-яку тканину, в будь-який орган: стінку кишки, сечовий міхур, сечовід, очеревину, плевру і навіть кісткову тканину (!). Вростання ЕМ в стінку м'язового органу (кишки, сечового міхура) супроводжується потовщенням його стінки за рахунок розростання залоз ендометрія, строми і сполучнотканинної реакції. В.П. Баскакова (1966, 1979) відзначена здатність ЕМ до поширення його частинок в інші тканини під час операцій, в результаті розриву ендометріоїдних кіст, а також гематогенно і лімфогенно.
Йдеться про здатність ЕМ до метастазування, тобто поширенню елементів ендометріозу з його вогнищ. Відсутність навколо вогнищ ЕМ сполучнотканинною капсули, здатність до інфільтруючим росту в навколишні тканини і метастазування, прискорення розростання після нерадикального видалення зближують ЕМ з пухлинним процесом (В.П. Баскаков, 1990). На думку багатьох авторів, ЕМ відноситься до групи пухлиноподібних процесів дисгормональной природи, здатних до малігнізації. Злоякісного переродження може піддатися генітальний і екстрагенітальний ЕМ в будь-якому віці, особливо при його поширених формах.
Середній вік хворих, яким ставиться діагноз ЕМ, 25-30 років, однак нерідко ЕМ діагностується і у підлітків з синдромом альгодисменореи і / або хронічного болю в області малого тазу.
ЕМ ускладнює прояви таких захворювань, як геморой, проктит, парапроктит, тазовий тромбофлебіт, туберкульоз, запальні процеси внутрішніх геніталій і ін. В свою чергу, загострення, наприклад, аднекситу сприяє активізації ЕМ. Ряд екстрагенітальних захворювань: гепатит, холецистит, грип, ГРЗ, загострення виразкової хвороби шлунка та дванадцятипалої кишки, гастродуоденита і ін. Можуть провокувати загострення ЕМ.
Суттєве значення ЕМ має в ургентної клініці як причина гострого живота з усіма характерними клінічними проявами: приступообразні болю, що супроводжуються нудотою, блювотою, запаморочення, перитонеальні симптоми.
клінічна картина
Як правило, ЕМ виявляють в репродуктивний період, оскільки існує залежність між розвитком ендометріоїдних вогнищ і гормональним фоном жінки. Найбільша кількість скарг пацієнтки пред'являють перед початком і під час менструації; після припинення кровотечі стан зазвичай поліпшується. Основним симптомом ЕМ є біль, локалізація якої залежить від розташування ендометріоїдних розростань. При генітальному ЕМ пацієнтки можуть пред'являти скарги на біль в спині і попереку, біль під час статевого акту і дефекації, хворобливі позиви на сечовипускання.
Симптоми ЕМ досить різноманітні, і не існує жодного патогномоничного саме для цього захворювання. Найбільш часто спостерігаються синдроми альгодисменореи, гиперполименореи, так званий синдром хронічного болю в області малого тазу, дискомфорт в області прямої кишки, діаспорян, невиношування вагітності, безпліддя (табл. 1).
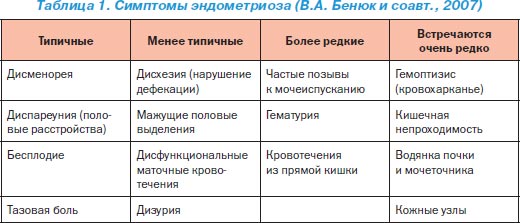
За даними проведених досліджень, ЕМ виявлено у 70-71% жінок, що скаржаться на біль в області малого тазу, у 71-76% - з дисменореей, у 44% - з диспареунией і у 15-20% - з безпліддям.
Вважається, що характер скарг визначається локалізацією ендометріоїдних вогнищ, хоча інтенсивність болю далеко не завжди корелює з тяжкістю захворювання. Зрідка ЕМ поєднується з обструкцією шлунково-кишкового тракту або дизурическими розладами. Циклічні кровохаркання або навіть розвиток пневмотораксу (гемоторакса) під час менструації зустрічаються при дисемінації ЕМ в легені.
підтвердження діагнозу
Піхвові дослідження, огляд з використанням дзеркал і трансвагінальна ультрасонографія дозволяють визначити у хворих ЕМ помірне збільшення і болючість матки, фіксований або нефіксований її загин, освіту чутливих вузликів в задньому склепінні піхви, збільшення і хворобливість маткових труб і яєчників.
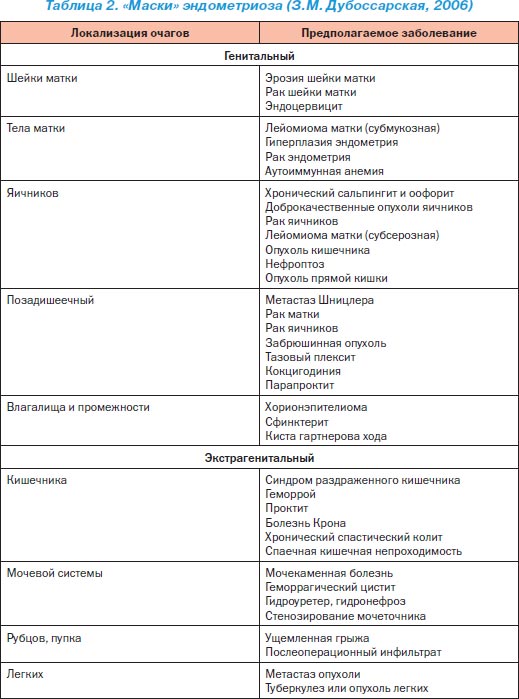
Характерним для ЕМ є виявлення при пальпації вузлуватих утворень вздовж потовщених крижово-маткових зв'язок, які добре визначаються при ректальному або комбінованому ректовагінальном дослідженні на задній стінці матки і в задньому дугласовом (прямокишково-матковому) просторі. Облітерація дугласова кишені з фіксацією матки в retroversio свідчить про поширеність патологічного процесу. Залучення до процесу яєчників проявляється їх тяжистость або збільшенням, якщо сформувалися «шоколадні» кісти. Аденоміоз (внутрішній ЕМ), тобто проростання ендометрію в міометрій, проявляється збільшенням і розм'якшенням матки, часто нерівномірним. Однак ці симптоми часто можуть бути відсутні (табл. 2).
При підозрі на ЕМ стандартне клінічне обстеження повинно бути направлено на встановлення ступеня поширеності і поразки сечовивідних шляхів і кишечника, виняток онкологічної патології і включати: цитологічне дослідження мазка з шийки матки на атипові клітини, кольпоцервікоскопія, пробу Шиллера, УЗД органів малого тазу з використанням трансвагінального та брюшностеночного (секторальних) датчиків; при необхідності - екскреторну урографію, цистоскопію, ирригоскопию, ректороманоскопию; гістологічне дослідження матеріалу, взятого при гістероскопії або фракційному діагностичному соскобе, рентгенографію поперекового відділу хребта (при необхідності), визначення онкомаркерів (СА-125, СА 19-9), консультацію фахівців (терапевта, хірурга, невролога, уролога, психотерапевта); при необхідності - проведення УЗД молочних залоз і мамографія.
Обстеження завершується інтерпретацією отриманих результатів дослідження, формулюванням остаточного діагнозу, плануванням подальших лікувально-діагностичних заходів в умовах спеціалізованого лікувального закладу. Надалі, за показаннями, проводяться лапароскопія з хромотубаціей, гістероскопія, комп'ютерна томографія органів малого таза, визначення вмісту гормонів в крові (фолікулостимулюючого гормону (ФСГ), лютеїнізуючого гормону (ЛГ), пролактину, естрадіолу, прогестерону), оцінка стану імунного гомеостазу, маркерів апоптозу та ін.
На підставі результатів обстеження, встановлення діагнозу та основних клінічних проявів захворювання, а також віку хворої, соматичної патології, ступеня ураження геніталій і залучення в процес суміжних органів визначаються тактика і обсяг лікувальних заходів.
Достовірний діагноз ЕМ може бути встановлений тільки кваліфікованим лікарем після ендоскопічного дослідження з наступним гістологічним підтвердженням. Характерною гістологічною особливістю ЕМ є наявність переповнених гемосидерином макрофагів, а також поєднання залозистого ендометріоподобние епітелію і цитогенной строми. Відсутність навколо патологічного вогнища сполучнотканинною капсули свідчить про його здатність до інфільтрації в навколишні органи і тканини з деструкцією останніх.
Диференціальна діагностика
Перед вибором тактики лікування ЕМ необхідно провести диференціальну діагностику з рядом захворювань, що мають подібну клінічну картину.
Для ранньої діагностики ЕМ поряд з аналізом клінічних даних, використанням ультразвукового, ендоскопічного і магнітно-резонансного дослідження вельми перспективним є метод виявлення пухлинних антигенів. Найбільш широко використовуваним діагностичним маркером є пухлинний антиген СА-125. Цей високомолекулярний глікопротеїн може бути визначений імунними методами за допомогою моноклональних антитіл. За даними літератури, у 95-97% здорових жінок рівень СА-125 не перевищує 35 Од / мл.
Високий рівень СА-125 в сироватці крові визначають при ЕМ, а також при цирозі печінки, гострому панкреатиті, раку шлунка і міомі матки. Тому діагностика ЕМ за допомогою даного тесту без повного комплексу лабораторно-інструментальних досліджень не правомірна, проте безперечну цінність має моніторинг концентрації СА-125 в сироватці крові пацієнток для визначення динаміки захворювання, тактики подальшого лікування і його ефективності.
Пухлина-асоційованим є також вуглеводний антиген СА 19-9. Незважаючи на невисоку чутливість даного маркера для діагностики ЕМ, одночасне дослідження змісту СА-125 і СА 19-9 дозволяє поліпшити діагностику захворювання. Великий діагностичний інтерес представляє також визначення рівня запальних маркерів - інтерлейкіну-6 в сироватці крові і чинника некрозу пухлини в перитонеальній рідині.
Трактування визначення в крові пухлинних маркерів з метою диференціальної діагностики ЕМ:
- СА (Саnсег аntigen) 19-9 - підвищення рівня в середньому до 30 Од / мл;
- СЕА (Саnсег Еmbryonic antigen) - підвищення рівня;
- СА-125 - підвищення рівня в середньому до 28 Од / мл, в деяких випадках - значно;
- СА 72-41 - підвищення рівня.
діагностична стратегія
Різноманітність клінічних проявів ЕМ і відсутність патогномоничного саме для цього захворювання симптому визначають складну діагностичну задачу в практичній діяльності гінеколога. Найбільш часто відзначається так званий синдром хронічного болю в області малого тазу. За рекомендацією Американської асоціації акушерів і гінекологів, в діагностиці ЕМ велике значення має послідовне виключення інших причин болю цієї локалізації. Виявлені при ретельному гінекологічному дослідженні вузлові утворення уздовж потовщених крижово-маткових зв'язок, збільшення і фіксація матки в ретроверсія, тяжистость або збільшення яєчників змушують лише припустити наявність ЕМ. Лабораторні тести і магнітно-резонансне дослідження також не мають достатньої діагностичної точності. Тому золотим стандартом в діагностиці ЕМ є лапароскопія, яка дозволяє виявити і оцінити поширеність захворювання, а також встановити його стадію.
Найчастіше ендометріоїдні вогнища локалізуються в яєчниках, задньому дугласовом просторі, широкої зв'язці матки, прямої і сигмовидної кишки, сечовому міхурі та термінальному відділі сечоводів (структури перераховані в порядку зменшення частоти локалізації). Ендометріоїдні вогнища мають різний вигляд, тому для правильної діагностики дуже важливим є наявність досвіду у ендоскопіст. Крім класичних темно-синюшним дрібних розсіяних вогнищ можуть бути виявлені білі, червоні або пухирчасті прозорі імплантати, білі або жовтуваті папули, геморагічні вогнища, вузлуваті імплантати, а також фіброзні (минулі зворотний розвиток) ділянки (PY Lu, SJ Ory, 1995).
Во время дослідження дуже важліво Встановити стадію захворювання; найбільш часто в Сейчас годину для цього Використовують класіфікацію Американського товариства фертільності (AFS). Встановлення стадії ЕМ полегшує об'єктивну оцінку ефектівності терапії та порівняння результатів різніх методів лікування. Після встановлення стадії захворювання лікувальну тактику індивідуалізують відповідно цілям терапії. Більшість хворих можна розподілити на три основні групи: ЕМ з наявністю безпліддя, при наявності больового синдрому або без нього; ЕМ з больовим синдромом (при відсутності безпліддя) при бажанні пацієнтки зберегти дітородну функцію; ЕМ з больовим синдромом при небажанні більше мати дітей.
Такий розподіл пацієнток допомагає сконцентрувати увагу на основну мету лікування. Крім лапароскопії, в практичних умовах з діагностичною метою широко застосовується ультрасонографія. За даними Львівського перинатального центру (І. Верніковскій, 1997), сонографічний діагноз майже завжди підтверджується при проведенні гістероскопії, лапароскопії та гістологічного дослідження препаратів після гістеректомії. Використання вагінального датчика дає можливість чітко встановити специфічні зміни стінок матки при наявності аденоміозу: структура міометрія ячеистая, з дрібними гіперехогенних точковими ділянками.
Лікування ЕМ представляє досить складну задачу. Поряд з хірургічним лікуванням широко використовуються лікарські засоби, які дозволяють безкровно видалити або викликати атрофію (зникнення) вогнищ ендометріозу в будь-якому органі. Використовуються гормональні засоби, на тлі яких гальмується виділення яєчникових гормонів, які стимулюють щомісячні циклічні розростання і відторгнення (менструація) ендометрія і, відповідно, ендометріоїдних утворень.
Лікування ЕМ має бути комплексним, диференційованим, а також враховувати вік хворого, її ставлення до відновлення репродуктивної функції, особливості особистості, локалізацію, поширеність і тяжкість перебігу процесу, поєднання з запальним процесом, його наслідки (рубцево-спайкові процеси), гіперпластичні процеси ендометрія та деструктивні зміни в яєчниках і матці.
Основні етапи неоперативного і хірургічного лікування ЕМ завершуються реабілітаційним лікуванням, мета якого - усунення залишкових порушень, відновлення працездатності та інших видів соціальної активності.
У лікуванні зовнішнього ЕМ більш ефективна комбінована терапія - поєднання хірургічного втручання і гормонотерапії.
Можливості терапії невпинно розширюються, тому лікаря нерідко доводиться стикатися з певними труднощами при виборі оптимальної тактики. Необхідно направити лікування на досягнення конкретної мети, з огляду на бажання пацієнтки. Традиційно лікування безпліддя при початковій і помірній стадіях ЕМ починають з вичікувальної тактики. Природно, це не означає повної відмови від лікування, наприклад, альгодисменореи або порушень овуляції.
Вичікувальна тактика не виправдана при лікуванні поширених форм ЕМ (3-я і 4-я стадії за класифікацією AFS), при безплідді, різко вираженому больовому синдромі або їх поєднанні. В даний час перевага віддається комбінованого медикаментозного і, при наявності показань, хірургічного лікування хворих ЕМ.
До абсолютних показань для хірургічного лікування ЕМ слід віднести: ендометріоїдні кісти яєчників, післяопераційного рубця і пупка, ретроцервікальний ЕМ, відсутність вираженого ефекту від медикаментозної терапії, що проводиться безперервно протягом 6 місяців, залучення в патологічний процес інших органів і систем організму з порушенням їх функції ( кишечник, сечові органи та ін.), гнійне запалення придатків матки, уражених ЕМ, виражений спайковий процес, що є основною причиною безпліддя.
Відносними показаннями до хірургічного лікування ЕМ є: непереносимість застосовуваних лікарських препаратів, поєднання ЕМ з аномаліями статевих органів, міома матки, що підлягають оперативному видаленню.
Хірургічне лікування може бути консервативним і радикальним. Консервативне хірургічне лікування ЕМ покликане зберегти або поліпшити репродуктивну функцію шляхом руйнування або видалення ендометріоїдних вогнищ (висічення, електрокоагуляція, лазерна коагуляція) зі збереженням репродуктивних органів. Зазначені процедури проводяться під час лапаротомії або лапароскопії. Часто одночасно проводяться додаткові втручання: роз'єднання зрощень, фіксація матки і яєчників, пластика маткових труб і т.д., іноді із застосуванням мікрохірургічної техніки.
За літературними даними, особливих переваг лапароскопічної хірургії перед традиційною при лікуванні безпліддя не виявлено. Радикальним хірургічним лікуванням важкого больового синдрому при ЕМ є абдомінальна екстирпація матки з придатками (тотальна абдомінальна гістеректомія із зарубіжної термінології). Цей метод рекомендується пацієнткам, у яких медикаментозне і консервативне хірургічне лікування виявилося неефективним і які згодні на втрату репродуктивної функції в результаті Органоуносящіе операції. Після екстирпації матки з придатками з максимально можливим вилученням ендометріоїдних вогнищ больовий синдром зникає у 90% пацієнток.
При наявності показань методом вибору є хірургічне лікування. Оптимально і найбільш перспективно усунення больового синдрому зі збереженням або поліпшенням репродуктивної функції пацієнток. З цією метою під час лапароскопії або лапаротомії видаляють вогнища ЕМ з подальшою денервацией. Так, за даними проведених досліджень, позитивні результати отримані після лапароскопічного видалення вогнища в поєднанні з перетином крижово-маткових зв'язок або пресакральної невректоміі. Для хірургічного лікування при ЕМ яєчника застосовують лапароскопічну цистектомії або лапароскопічний дренаж з електрокоагуляції. Дані рандомізованого клінічного дослідження свідчать про кращому результаті при використанні лапароскопічної цистектомії.
Ретроспективний аналіз стану жінок через 10 років після екстирпації матки з матковими трубами показав рецидив ЕМ і больового синдрому в 10% випадків, після екстирпації матки - в 62%. Тому в даний час після оперативного видалення вогнища найбільш ефективним є противорецидивное призначення агоністів гонадотропін-рилізинг-гормону (ГРГ).
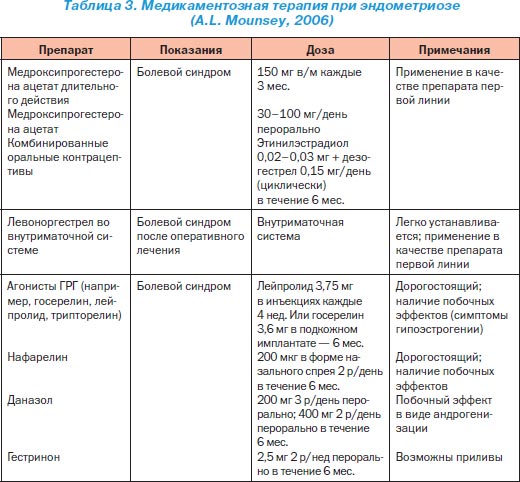
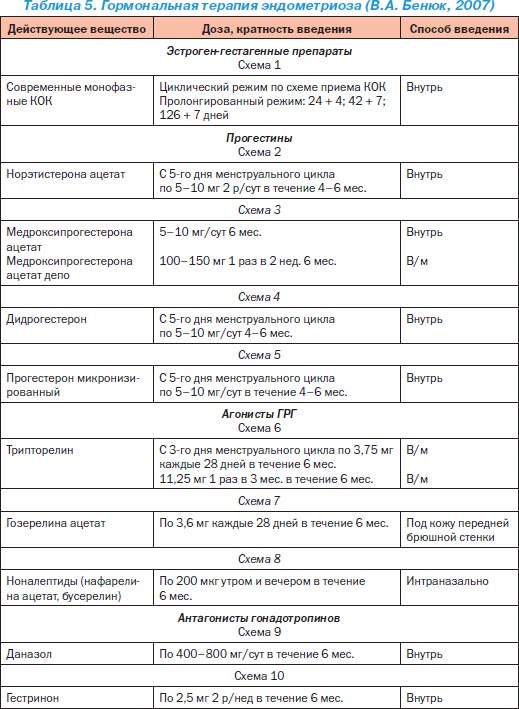
Медикаментозна терапія є основним методом лікування ЕМ. Ендометріоїдниє імплантати містять рецептори до прогестерону, естрогенів і андрогенів, що пояснює клінічну ефективність гормональної терапії. Принципи гормонального лікування ЕМ, що сприяє розвитку гипотрофических і атрофічних процесів в ендометріоїдних вогнищах, засновані на зниженні гіперактивності системи «гіпоталамус - гіпофіз - яєчники». Найбільш часто в даний час застосовуються естроген-гестагенні препарати з посиленим гестагенових компонентом (комбіновані оральні контрацептиви - КОК) по контрацептивної схемою і чисті гестагени - в основному, безперервному режимі, протягом 6-12 місяців і більше (табл. 3-5).
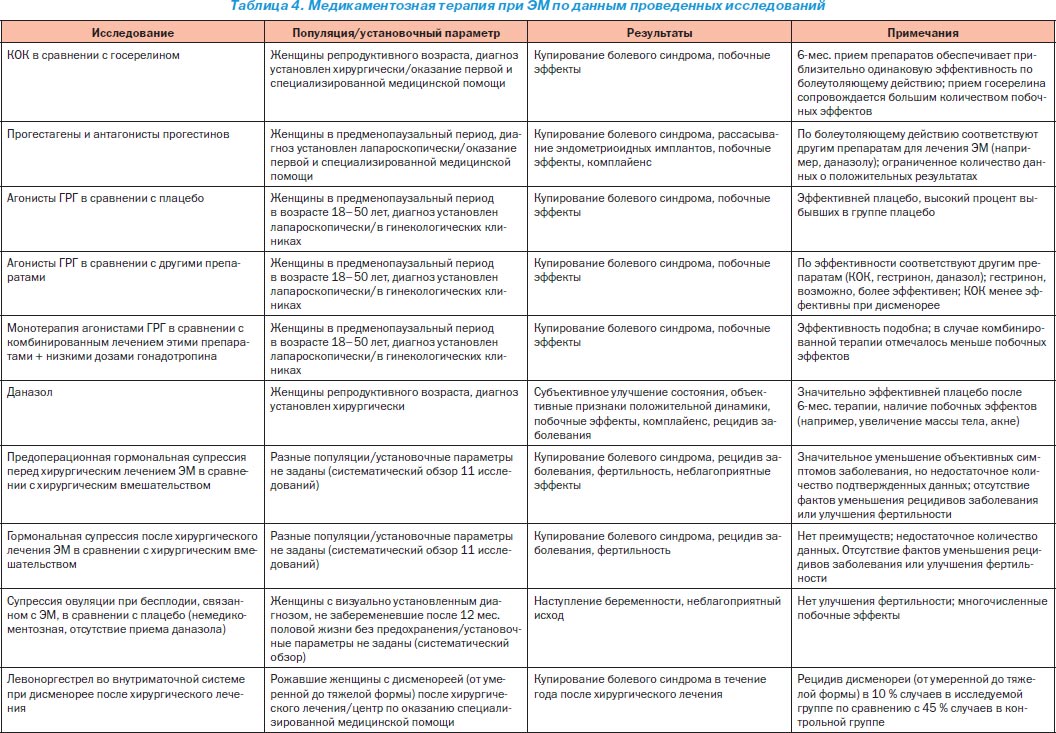
В останні роки досить широке застосування отримали антігонадотропіни - даназол і його аналоги, які є похідними 17-альфа-етінілтестостерона. Даназол (дановал, данол) пригнічує секрецію ФСГ і ЛГ, що до мінімуму знижує секрецію естрогену і прогестерону яєчниками; це усуває гормональну підтримку ендометріоїдних імплантатів. Препарат витісняє тестостерон з його сполук з глобулінами, що підвищує вміст в крові вільного тестостерону і підсилює його андрогенний ефект. Після 6 міс. застосування даназола (добова доза від 400 до 600-800 мг в 3-4 прийоми) в середньому 90% жінок з помірною і середньої стадіями ЕМ відчувають ослаблення болю. Менш ефективний даназол при наявності виражених зрощень в малому тазу. Курс лікування даназолом тривалістю не менше 6 міс. дає значне поліпшення і при важких формах ЕМ; ефект триває ще до 6 міс. після закінчення курсу. Для лікування безпліддя застосування даназола є неефективним.
Слід зазначити, що до 80% пацієнток, які приймають даназол, відзначають побічні ефекти різного ступеня вираженості, що виникають в основному через його андрогенного дії: збільшення маси тіла, затримка рідини, акне, зменшення молочних залоз, атрофічний кольпіт, припливи, емоційна лабільність, напади рясного потовиділення, головний біль, тахікардія, нудота, випадання волосся, шкірний висип, гірсутизм, гіпертрофія клітора, огрубіння голосу і ін.
З особливою обережністю вирішується питання про призначення даназола при наявності хвороб нирок, печінки, серця, цукрового діабету (даназол підвищує потреба організму в інсуліні), а також в тих випадках, коли хвора приймає протисудомні засоби або антикоагулянти (даназол проявляє фібринолітичну активність). Значно краще переносяться і мають не менше вираженим лікувальним ефектом агоністи гонадотропін-рилізинг-гормону (люліберін): нафарелина ацетат (сінарел), трипторелин, бусерелін, декапептил-депо, госерелін-ацетат (золадекс), лейпрорелін і ін., Що випускаються для внутрішньом'язового ( по 3,75 мг щомісяця, один раз на місяць, курс до 6 міс.) і интраназального (два рази на день по 200 мг протягом 3-6 міс.) застосування.
Останнім часом в країнах Європи досить успішно застосовують антагоніст прогестинів - гестринон (етілноргестрінон, неместран). Механізм дії гестринона відрізняється від механізму дії агоністів ГРГ: він не тільки зменшує вивільнення гонадотропіну і тим самим пригнічує синтез стероїдів в яєчнику, але і проявляє пряме антагоністичну дію безпосередньо в ендометріоїдних тканини відносно естрогену і прогестерону шляхом блокування їх рецепторів.
Характерні побічні явища обумовлені андрогенною дією гестринона: акне, жирна шкіра, затримка рідини в організмі, збільшення маси тіла, гірсутизм, огрубіння голосу. З інших побічних ефектів можливі транзиторне підвищення активності трансаміназ (АЛТ, АСТ), зміна лібідо, припливи, зменшення розмірів молочних залоз, нервозність або депресія, зміна апетиту, головний біль, шлунково-кишкові розлади. Гестринон протипоказаний при лактації, хворобах печінки, нирок і серця, випускається в капсулах по 2,5 мг; лікування починають в перший день менструального циклу - призначають всередину по 2,5-5 мг два рази на тиждень. Тривалість курсу лікування 6-8 міс.
Багато авторів, з огляду на низьку вартість, досить високу ефективність і меншу кількість побічних ефектів порівняно з даназолом і його аналогами, рекомендують починати лікування ЕМ з комбінованих оральних контрацептивів або прогестинів (чистих гестагенів). До числа останніх відносяться: норколут (норетистерон), примолют-нор, Ацетомепрегенол, оргаметрил, утрожестан, дуфастон, які призначаються всередину по 5-10 мг 2-3 рази на день з 5-го по 25-й день менструального циклу або в безперервному режимі ; 17-оксипрогестерон капронат 12,5% - по 2 мл (250 мг) внутрішньом'язово на 16-19-й день циклу або по 1 мл (125 мг) один раз на тиждень - всього 20 ін'єкцій; депо-провера (медроксипрогестерону ацетат) - внутрішньом'язово по 100-150 мг кожні два тижні (всього 4 рази), потім по 100- 150 мг на місяць протягом 4-6 міс. Типовими побічними діями прогестінов є: проривні кровотечі, затримка рідини, набряк молочних залоз, депресія. Побічні явища зникають після відміни препарату. При проривних кровотечах призначають етинілестрадіол (мікрофоллін) по 20 мкг на добу протягом 1-2 тижнів.
У 1958 році R. Kistner вперше застосував комбіновані оральні контрацептиви в терапії ендометріозу. Він припустив, що зменшення проявів ЕМ при вагітності пов'язано з децідуалізаціей ендометріоїдних тканини під дією високого рівня естрогену і прогестерону. Механізм дії КОК полягає в придушенні виділення гонадотропних гормонів гіпофізом, уповільненні синтезу естрогенів в яєчниках, і, як наслідок, відзначається припинення проліферативних процесів в ендометрії. Тривале (протягом 9-12 міс.) Застосування КОК призводить до інволюції та атрофії залозистого епітелію ендометрію, в той час як стромальних компонент піддається децидуальної трансформації (стан псевдобеременности). В даний час перевага віддається призначенням мікродозованих КОК, що містять менше 30 мкг етинілестрадіолу (наприклад, логест, мерсілон, новинет, регулон, силест, Жанін), що, не погіршуючи результатів лікування, знижує ймовірність розвитку побічних ефектів.
При впливі на гіпоталамо-гіпофізарно-яєчникові зв'язку і безпосередньо на осередки ЕМ переслідується певна мета: домогтися їх регресу. Відомо, що під дією гормонів яєчників відбуваються циклічні зміни в ендометрії, а при відсутності гормонів або недостатньому їх кількості спостерігається атрофія слизової оболонки матки. Це справедливо і для ектопічеського ендометрія, хоча в ньому циклічні зміни менш виражені.
Лікуванню ЕМ препаратами КОК в останні роки приділяється особлива увага через його високу прийнятності та відносно невеликої кількості побічних реакцій. Поруч дослідників було переконливо показано, що основні побічні ефекти, що з'являються при прийомі КОК, більш виражені у вільний від прийому препарату 7-денний інтервал, так як в цей період рівень природних гонадотропінів підвищується. Для зменшення числа побічних реакцій, а також з огляду на, що ефект КОК залежить від тривалості застосування і досягає максимуму в кінці циклу лікування, була запропонована схема пролонгованої прийому препаратів.
Безперервний режим прийому КОК, за даними численних досліджень, особливо перспективний для використання з лікувальною метою, в тому числі і для лікування ЕМ. Ациклічні процеси мінімізують шанс «мініатюрної» менструації в ендометріоїдних гетеротопій і запобігають їх поширення при ретроградним занедбаності під час менструації.
При виборі оптимальної тактики лікування лікар нерідко стикається з певними труднощами. Це пов'язано з тим, що метод досягнення конкретної мети лікування повинен бути обраний з урахуванням бажань пацієнтки. Тому в кожному конкретному випадку необхідна індивідуальна цілеспрямована стратегія і тактика.
Важливе значення в комплексному лікуванні ЕМ має симптоматична патогенетично обґрунтована терапія. Вона включає застосування імуномодуляторів (спленин, левамізол, тактовно, тималін, амізон, иммунал і ін.), Антиоксидантів (унітіол, тіосульфат натрію, аскорбінова кислота, токоферолу ацетат), гепатотропних препаратів (карсил, сілібор, хофитол, легалон, ессенціале, липостабил) , антигістамінних (тавегіл, супрастин, фенкарол) та седативних засобів.
Велику роль відіграють так звана розсмоктуються терапія з використанням преформованих фізичних чинників (апаратна фізіотерапія), голкорефлексотерапія. З огляду на наявний больовий синдром, доцільно призначення інгібіто- рів простагландінсінтетази (НПЗЗ): ібупрофен, ортофен, індометацин, піроксикам, мовилося, целекоксиб, рофіка, диклофенак та ін.
Фармакотерапія ЕМ підвищує фертильність і, безумовно, є ефективною для лікування больового синдрому. Її доцільно застосовувати як початкову у пацієнток з больовим синдромом. Ефект консервативного хірургічного лікування без подальшої медикаментозної терапії короткочасний. Для пацієнток з помірно вираженою симптоматикою рекомендуються комбіновані оральні контрацептиви. Прогестини, даназол, аналоги гонадотропін-рилізинг-гормону доцільно призначати при важких формах захворювання
Жінкам, у яких больовий синдром не піддається медикаментозної терапії і значно погіршує якість життя, доцільно погодитися з втратою репродуктивної функції, так як єдиним ефективним методом лікування в цих випадках є викорінення матки з придатками. Цю ж операцію можна запропонувати окремим жінкам в передклімактеричному віці, проте слід мати на увазі, що болі у них можуть зникнути спонтанно після настання менопаузи.
Для лікування безпліддя непогані результати дають медикаментозна індукція овуляції і внутрішньоматкова інсемінація, тому ці методи рекомендуються після 3-6 міс. вичікувальної тактики. При відсутності ефекту показано застосування запліднення in vitro.
На сучасному етапі прийнято вважати, що жоден з методів лікування ЕМ не є універсальним для ліквідації всіх симптомів цього захворювання. Тому в кожному конкретному випадку необхідно вибирати індивідуальну цілеспрямовану стратегію і тактику. Не існує алгоритму, що дає можливість вибрати найбільш доцільний з безлічі методів лікування.
Вибір лікувальної тактики багато в чому залишається емпіричним і базується на клінічному досвіді лікаря, бо rerum omnium magister usus (у всіх справах наставник - досвід) (табл. 6).