- Йога начинающим видео
- Хулахуп танец видео
- Смотреть моя тренировка видео
- Видео тренировки александра емельяненко
- Как правильно крутить обруч на бедрах видео
- Тренировки в кудо видео
- Тренировки рой джонса видео
- Йога онлайн смотреть видео
- Тренировки костя дзю видео
- Видео тренировки роя джонса
- Видео спинальной
- Айенгар йога видео
- Йога для женщин на видео
- Правильно крутить обруч видео
- Плиометрические отжимания видео
- Новости

Управление Здравоохранения Евпаторийского городского совета (С)2011
67 гостей
Порушення білкового обміну - Патофізіологія. Том 2 - Медична навчальна література
- Порушення розщеплення і всмоктування білків.
- Уповільнення надходження амінокислот в органи і тканини.
- Порушення синтезу білків.
- Патологія проміжного білкового обміну (порушення обміну амінокислот).
- Зміна швидкості розпаду білка.
- Патологія кінцевого етапу білкового обміну.
Забезпечення організму білками з декількох джерел визначає різноманітну етіологію порушень білкового обміну. Останні можуть носити первинний або вторинний характер.
Однією з найбільш частих причин загальних порушень білкового обміну є кількісна або якісна білкова недостатність первинного (екзогенного) походження. Дефекти, пов'язані з цим, обумовлені обмеженням надходження екзогенних білків при повному або частковому голодуванні, низькою біологічною цінністю харчових білків, дефіцитом незамінних амінокислот (валіну, ізолейцину, лейцину, лізину, метіоніну, треоніну, триптофану, фенілаланіну, гістидину, аргініну).
При деяких захворюваннях порушення білкового обміну можуть розвиватися в результаті розлади травлення і всмоктування білкових продуктів (при гастроентеритах, виразковий коліт), підвищеного розпаду білка в тканинах (при стресі, інфекційних хворобах), посиленою втрати ендогенних білків (при крововтратах, нефрозі, травмах), порушення синтезу білка (при гепатитах). Наслідком зазначених порушень часто є вторинна (ендогенна) білкова недостатність з характерним негативний баланс азоту.
При тривалій білкової недостатності різко порушується біосинтез білків в різних органах, що веде до патологічних змін обміну речовин в цілому.
Білкова недостатність може розвинутися і при достатньому надходженні білків з їжею, але при порушенні білкового обміну.
Вона може бути обумовлена:
- порушенням розщеплення і всмоктування білків в ШКТ;
- уповільненням надходження амінокислот в органи і тканини;
- порушенням біосинтезу білка; порушенням проміжного обміну амінокислот;
- зміною швидкості розпаду білка;
- патологією утворення кінцевих продуктів білкового обміну.
Порушення розщеплення і всмоктування білків.
У травному тракті білки розщеплюються під впливом протеолітичних ферментів. При цьому, з одного боку, білкові речовини та інші азотисті сполуки, що входять до складу їжі, втрачають свої специфічні особливості, з іншого боку, з білків утворюються амінокислоти, з нуклеїнових кислот - нуклеотиди і т.д. Утворилися при перетравленні їжі або перебували в ній азотовмісні речовини з невеликою молекулярною масою піддаються всмоктуванню.
Розрізняють первинні (при різних формах патології шлунка і кишечника - хронічних гастритах, виразковій хворобі, раку) і вторинні (функціональні) розлади секреторної і всмоктувальної функції епітелію в результаті набряку слизової оболонки шлунка і кишечника, порушення перетравлення білків і всмоктування амінокислот в шлунково-кишковому тракті .
Основні причини недостатнього розщеплення білків полягають в кількісному зменшенні секреції соляної кислоти і ферментів, зниження активності протеолітичних ферментів (пепсину, трипсину, хімотрипсину) і пов'язаному з цим недостатнім утворенням амінокислот, зменшенні часу їх впливу (прискорення перистальтики). Так, при ослабленні секреції соляної кислоти знижується кислотність шлункового соку, що веде до зменшення набухання харчових білків в шлунку і ослаблення перетворення пепсиногену в його активну форму - пепсин. У цих умовах частина білкових структур переходить зі шлунка в дванадцятипалу кишку в незміненому стані, що ускладнює дію трипсину, хімотрипсину та інших протеолітичних ферментів кишечника. Дефіцит ферментів, що розщеплюють білки рослинного походження, веде до непереносимості злакових білків (рису, пшениці та ін.) І розвитку целіакії.
Недостатнє утворення вільних амінокислот з харчових білків може відбуватися в разі обмеження надходження в кишечник соку підшлункової залози (при панкреатиті, здавленні, закупорці протоки). Недостатність функції підшлункової залози веде до дефіциту трипсину, хімотрипсину, карбоангідрази А, Б та інших протеаз, що впливають на довгі поліпептидні ланцюга або розщеплюють короткі олігопептиди, що знижує інтенсивність порожнинного або пристінкового травлення.
Недостатня дія травних ферментів на білки може виникнути внаслідок прискореного проходження харчових мас по кишечнику при посиленні його перистальтики (при ентероколітах) або пішли на зменшення площі всмоктування (при оперативному видаленні значних ділянок тонкого кишечника). Це веде до різкого скорочення часу контакту вмісту хімусу з апікальної поверхнею ентероцитів, незавершеності процесів ензиматичного розпаду, а також активного і пасивного всмоктування.
Причинами порушення всмоктування амінокислот є пошкодження стінки тонкого кишечника (набряк слизової оболонки, запалення) або нерівномірне за часом всмоктування окремих амінокислот. Це веде до порушення (дисбалансу) співвідношення амінокислот в крові і синтезу білка в цілому, оскільки незамінні амінокислоти повинні надходити в організм у певних кількостях і співвідношеннях. Найчастіше має місце нестача метіоніну, триптофану, лізину та інших амінокислот.
Крім загальних проявів порушення амінокислотного обміну, можуть бути специфічні порушення, пов'язані з відсутністю конкретної амінокислоти. Так, недолік лізину (особливо в організмі, що розвивається) затримує зростання і загальний розвиток, знижує вміст в крові гемоглобіну та еритроцитів. При нестачі в організмі триптофану виникає гіпохромна анемія. Дефіцит аргініну призводить до порушення сперматогенезу, а гістидину - до розвитку екземи, відставання в рості, пригнічення синтезу гемоглобіну.
Крім того, недостатнє перетравлення білка у верхніх відділах шлунково-кишкового тракту супроводжується посиленням переходу продуктів його неповного розщеплення в товстий кишечник і прискоренням процесу бактеріального розщеплення амінокислот. В результаті збільшується утворення отруйних ароматичних сполук (індолу, скатол, фенолу, крезолу) і розвивається загальна інтоксикація організму цими продуктами гниття.
Уповільнення надходження амінокислот в органи і тканини.
Всосавшиеся з кишечника амінокислоти надходять безпосередньо в кров і частково в лімфатичну систему, представляючи собою запас різноманітних азотистих речовин, які потім беруть участь у всіх видах обміну. У нормі амінокислоти, всмоктатися в кров з кишечника, циркулюють в крові 5 - 10 хв і дуже швидко поглинаються печінкою і частково іншими органами (нирками, серцем, м'язами). Збільшення часу цієї циркуляції вказує на порушення здатності тканин і органів (в першу чергу печінки) поглинати амінокислоти.
Оскільки ряд амінокислот є вихідним матеріалом при утворенні біогенних амінів, затримка їх в крові створює умови для накопичення в тканинах і крові відповідних протеіногенних амінів і прояви їх патогенного дії на різні органи і системи. Підвищений вміст в крові тирозину сприяє накопиченню тираміну, який бере участь в патогенезі злоякісної гіпертонії. Тривале підвищення вмісту гістидину веде до збільшення концентрації гістаміну, що спричиняє порушення кровообігу і проникності капілярів. Крім того, підвищення вмісту амінокислот в крові виявляється збільшенням їхнього виведення з сечею і формуванням особливої форми порушень обміну - аминоацидурии. Остання може бути загальною, пов'язаної з підвищенням концентрації в крові декількох амінокислот, або виборчою - при збільшенні вмісту в крові будь-якої однієї амінокислоти.
Порушення синтезу білків.
Синтез білкових структур в організмі є центральною ланкою метаболізму білка. Навіть невеликі порушення специфічності біосинтезу білка можуть вести до глибоких патологічних змін в організмі.
Серед причин, що викликають порушення синтезу білка, важливе місце займають різні види аліментарної недостатності (повне, неповне голодування, відсутність в їжі незамінних амінокислот, порушення кількісних співвідношень між незамінними амінокислотами, які надходять в організм). Якщо, наприклад, в тканинному білку триптофан, лізин, валін містяться в рівних співвідношеннях (1: 1: 1), а з харчовим білком ці амінокислоти надходять в співвідношенні (1: 1: 0,5), то синтез тканинного білка буде забезпечуватися при це тільки наполовину. При відсутності в клітинах хоча б однієї з 20 незамінних амінокислот припиняється синтез білка в цілому.
Порушення швидкості синтезу білків може бути обумовлено розладом функції відповідних генетичних структур, на яких відбувається цей синтез (транскрипція ДНК, трансляція, реплікація). Пошкодження генетичного апарату може бути як спадковим, так і набутим, що виникли під впливом різних мутагенних чинників (іонізуючого випромінювання, ультрафіолетового опромінення та ін.). Порушення синтезу білка можуть викликати деякі антибіотики. Так, помилки в зчитуванні генетичного коду можуть виникнути під впливом стрептоміцину, неоміцину та деяких інших антибіотиків. Тетрацикліни гальмують приєднання нових амінокислот до зростаючої поліпептидного ланцюга. Мітоміцин пригнічує синтез білка за рахунок алкілування ДНК (освіта міцних ковалентних зв'язків між її ланцюгами), перешкоджаючи розщепленню ниток ДНК.
Однією з важливих причин, що викликають порушення синтезу білків, може з'явитися порушення регуляції цього процесу. Інтенсивність і спрямованість білкового обміну регулюють нервова і ендокринна системи, дія яких полягає, ймовірно, в їх вплив на різні ферментні системи. Клінічний і експериментальний досвід показують, що відключення органів і тканин від ЦНС призводить до місцевого порушення процесів обміну в денервірованних тканинах, а пошкодження ЦНС викликає розлади білкового обміну. Видалення кори головного мозку у тварин веде до зниження синтезу білка.
Соматотропний гормон гіпофіза, статеві гормони та інсулін мають стимулюючий вплив на синтез білка. Нарешті, причиною патології синтезу білка може стати зміна активності ферментних систем клітин, що беруть участь в біосинтезі білка. У вкрай виражених випадках мова йде про блокування метаболізму, що представляє собою вид молекулярних розладів, що складають основу деяких спадкових захворювань.
Результатом дії всіх перерахованих факторів є обрив або зниження швидкості синтезу як окремих білків, так і білка в цілому.
Виділяють якісні і кількісні порушення біосинтезу білків. Про те. яке значення можуть мати якісні зміни біосинтезу білків в патогенезі різних захворювань, можна судити на прикладі деяких видів анемій при появі патологічних гемоглобінів. Заміна тільки одного амінокислотного залишку (глутаміну) в молекулі гемоглобіну на валін призводить до важкого захворювання - серповидноклеточной анемії.
Особливий інтерес представляють кількісні зміни в біосинтезі білків органів і крові, що призводять до зсуву співвідношень окремих фракцій білків у сироватці крові - диспротеинемии. Виділяють дві форми диспротеинемией: гіперпротеїнемія (збільшення вмісту всіх або окремих видів білків) і гіпопротеїнемія (зменшення вмісту всіх або окремих білків). Так, ряд захворювань печінки (цироз, гепатит), нирок (нефрит, нефроз) супроводжуються вираженим зменшенням вмісту альбумінів. Ряд інфекційних захворювань, що супроводжуються великими запальними процесами, веде до збільшення вмісту γ-глобулінів.
Розвиток диспротеинемии супроводжується, як правило, серйозними зрушеннями в гомеостазі організму (порушенням онкотичного тиску, водного обміну). Значне зменшення синтезу білків, особливо альбуміну і γ-глобулінів, веде до різкого зниження опірності організму до інфекції, зниження імунологічної стійкості. Значення гипопротеинемии в формі гипоальбуминемии визначається ще й тим, що альбумін утворює більш-менш міцні комплекси з різними речовинами, забезпечуючи їх транспорт між різними органами і перенесення через клітинні мембрани за участю специфічних рецепторів. Відомо, що солі заліза і міді (надзвичайно токсичні для організму) при pH сироватки крові важко розчиняються і транспорт їх можливий тільки у вигляді комплексів із специфічними білками сироватки (трансферрином і церулоплазміном), що запобігає інтоксикацію цими солями. Близько половини кальцію утримується в крові в формі, пов'язаної з альбумінами сироватки. При цьому в крові встановлюється певний динамічна рівновага між пов'язаної формою кальцію і його іонізованими сполуками.
При всіх захворюваннях, що супроводжуються зниженням вмісту альбумінів (захворювання нирок) послаблюється і здатність регулювати концентрацію іонізованого кальцію в крові. Крім того, альбуміни є носіями деяких компонентів вуглеводного обміну (глікопротеїди) і основними переносниками вільних (неестеріфіцірованних) жирних кислот, ряду гормонів.
При ураженні печінки і нирок, деяких гострих і хронічних запальних процесах (ревматизмі, інфекційному міокардиті, пневмонії) в організмі починають синтезуватися особливі білки зі зміненими властивостями або невластиві нормі. Класичним прикладом хвороб, викликаних наявністю патологічних білків, є хвороби, пов'язані з присутністю патологічного гемоглобіну (гемоглобінози), порушення згортання крові при появі патологічних фібриногеном. До незвичайним білків крові відносяться кріоглобуліни, здатні випадати в осад при температурі нижче 37 ° С, що веде до тромбоутворення. Поява їх супроводжує нефроз, цироз печінки і інші захворювання.
Патологія проміжного білкового обміну (порушення обміну амінокислот).
Основні шляхи проміжного обміну білка - це реакції переамінування, дезамінування, амідування, декарбоксилирования, переметилювання, пересульфірованія.
Центральне місце в проміжному обміні білків займає реакція переамінування, як основне джерело утворення нових амінокислот.
Порушення переамінування може виникнути в результаті недостатності в організмі вітаміну В6. Це пояснюється тим, що фосфорілірованний форма вітаміну В6 - фосфопиридоксаль - є активною групою трансаміназ - специфічних ферментів переамінування між аміно- і кетокислот. Вагітність, тривалий прийом сульфаніламідів гальмують синтез вітаміну В6 і можуть послужити причиною порушення обміну амінокислот.
Патологічне посилення реакції переамінування можливо в умовах пошкодження печінки і інсулінової недостатності, коли значно збільшується вміст вільних амінокислот. Нарешті, зниження активності переаминирования може статися в результаті пригнічення активності трансаміназ через порушення синтезу цих ферментів (при білковому голодуванні) або порушення регуляції їх активності з боку деяких гормонів. Так, тирозин (незамінна амінокислота), що надходить з білками їжі і утворюється з фенілаланіну, частково окислюється в печінці до фумарової і ацетоуксусной кислот. Однак це окислення тирозину відбувається тільки після його переампнірованія з α-кетоглутаровой кислотою. При білковому виснаженні переаминирование тирозину помітно ослаблене, внаслідок цього порушено його окислення, що призводить до збільшення вмісту тирозину в крові. Накопичення тирозину в крові і виділення його з сечею можуть бути пов'язані і з спадково обумовленим дефектом тірозінамінотрансферази. Клінічний стан, що розвивається в результаті цих порушень, відоме під назвою «тирозиноз». Для хвороби характерні цироз печінки, рахітоподібних зміни кісток, геморагії, ураження канальців нирок.
Процеси переамінування амінокіслот тісно пов'язані з процесами окисного дезамінування. в ході которого відбувається ферментативна відщеплення аміаку від амінокіслот. Дезаминирование візначає Утворення кінцевіх продуктів білкового обміну и вступ амінокіслот в енергетичний обмін. Ослаблення дезамінування может вінікнуті внаслідок Порушення окіслювальніх процесів в тканинах (гіпоксії, гіповітамінозів С, РР, В2). Однако найбільш різке Порушення дезамінування настає при зніженні актівності амінооксідаз або внаслідок ослаблення їх синтезу (дифузно Ураження печінкі, білкова недостатність), або в результате відносної недостатності їх актівності (Збільшення вмісту в крови вільніх амінокіслот). Внаслідок порушення окисного дезамінування амінокислот відбувається ослаблення мочевінообразованія, підвищення концентрації амінокислот і збільшення виведення їх з сечею (аминоацидурия).
Проміжний обмін ряду амінокислот відбувається не тільки в формі переамінування і окисного дезамінування, а й шляхом їх декарбоксилювання (втрата СO2 з карбоксильної групи) з утворенням відповідних амінів, які отримали назву «біогенні аміни». Так, при декарбоксилюванні гістидину утворюється гістамін, тирозину - тирамін, 5-гідроксітріптофана - серотонін і т.д. Всі ці аміни біологічно активні і мають виражену фармакологічну дію на судини. Якщо в нормі вони утворюються в малих кількостях і досить швидко руйнуються, то при порушенні декарбоксилювання складаються умови для накопичення в тканинах і крові відповідних амінів і прояви їх токсичної дії. Причинами порушення процесу декарбоксилювання можуть служити посилення активності декарбоксилаз, гальмування активності амінооксідаз і порушення зв'язування амінів білками.
Зміна швидкості розпаду білка.
Білки організму постійно перебувають в динамічному стані: в процесі безперервного розпаду і біосинтезу. Порушення умов, необхідних для реалізації цього рухомого рівноваги, також може привести до розвитку загальної білкової недостатності.
Зазвичай напівперіод існування різних білків коливається в межах від декількох годин до багатьох діб. Так, біологічний час зменшення наполовину альбуміну людської сироватки становить близько 15 діб. Величина цього періоду в значній мірі залежить від кількості білків в їжі: при зменшенні зі тримання білків він збільшується, а при збільшенні - зменшується.
Значне збільшення швидкості розпаду білків тканин і крові спостерігається при підвищенні температури організму, великих запальних процесах, важких травмах, гіпоксії, злоякісних пухлинах, що пов'язано або з дією бактеріальних токсинів (в разі інфікування), або зі значним збільшенням активності протеолітичних ферментів крові (при гіпоксії ), або токсичною дією продуктів розпаду тканин (при травмах). У більшості випадків прискорення розпаду білків супроводжується розвитком в організмі негативного азотистого балансу в зв'язку з переважанням процесів розпаду білків над їх біосинтезу.
Патологія кінцевого етапу білкового обміну.
Основними кінцевими продуктами білкового обміну є аміак і сечовина. Патологія кінцевого етапу білкового обміну може проявлятися порушенням утворення кінцевих продуктів або порушенням їх виведення.
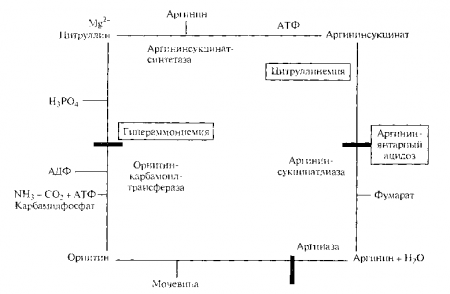
Мал. 9.3. Схема порушення синтезу сечовини
Зв'язування аміаку в тканинах організму має велике фізіологічне значення, так як аміак має токсичний ефект перш за все щодо центральної нервової системи, викликаючи її різке збудження. У крові здорової людини його концентрація не перевищує 517 мкмоль / л. Зв'язування і знешкодження аміаку здійснюється за допомогою двох механізмів: в печінці шляхом утворення сечовини, а в інших тканинах - шляхом приєднання аміаку до глутамінової кислоти (за допомогою амінування) з утворенням глутаміну.
Основним механізмом зв'язування аміаку є процес утворення сечовини в цитрулін-аргінінорнітіновом циклі (рис. 9.3).
Порушення утворення сечовини можуть настати в результаті зниження активності ферментних систем, що беруть участь в цьому процесі (при гепатитах, цирозі печінки), загальної білкової недостатності. При порушенні мочевінообразованія в крові і тканинах накопичується аміак і збільшується концентрація вільних амінокислот, що супроводжується розвитком гіперазотемію. При важких формах гепатитів та цирозу печінки, коли різко порушена її мочевінообразовательная функція, розвивається виражена аміачна інтоксикація (порушення функції центральної нервової системи з розвитком коми).
В основі порушення утворення сечовини можуть лежати спадкові дефекти активності ферментів. Так, збільшення концентрації аміаку (амоніємії) в крові може бути пов'язано з блокуванням карбаміл-фосфатсінтетази і орнітінкарбомо-ілтрансферази. каталізують зв'язування аміаку і освіту орнитина. При спадковому дефекті аргінінсукцінатсінтетази в крові різко збільшується концентрація цитруллина, в результаті з сечею екскретується цитрулін (до 15 г на добу), тобто розвивається цітруллінурія.
В інших органах і тканинах (м'язи, нервова тканина) аміак зв'язується в реакції амідування з приєднанням до карбоксильної групи вільних дикарбонових амінокислот. Головним субстратом служить глутамінова кислота. Порушення процесу амідування може відбуватися при зниженні активності ферментних систем, що забезпечують реакцію (глутамінази), або в результаті інтенсивного утворення аміаку в кількостях, що перевищують можливості його зв'язування.
Іншим кінцевим продуктом білкового обміну, що утворюється при окисленні креатину (азотна речовина м'язів), є креатинін. Нормальне добове вміст креатиніну в сечі становить близько 1-2 м
Креатинурія - підвищення рівня креатиніну в сечі - спостерігається у вагітних жінок і у дітей в період інтенсивного росту.
При голодуванні, авітамінозі Е, гарячкових інфекційних захворюваннях, тиреотоксикозі та інших захворюваннях, при яких спостерігаються порушення обміну в м'язах, креатинурія свідчить про порушення креатиновой обміну.
Інша загальна форма порушення кінцевого етапу білкового обміну виникає при порушенні виведення кінцевих продуктів білкового обміну при патології нирок. При нефриті відбувається затримка сечовини та інших азотистих продуктів в крові, залишковий азот збільшується і розвивається гиперазотемия. Крайнім ступенем порушення екскреції азотистих метаболітів є уремія.
При одночасному ураженні печінки і нирок виникає порушення утворення і виділення кінцевих продуктів білкового обміну.
Поряд із загальними порушеннями білкового обміну при білкової недостатності можуть виникати і специфічні порушення в обміні окремих амінокислот. Наприклад, при білкової недостатності різко послаблюється функція ферментів, які беруть участь в окисленні гистидина, а функція гістідіндекарбоксілази, в результаті дії якої з гістидину утворюється гістамін, не тільки не страждає, але, навпаки, посилюється. Це тягне за собою значне збільшення утворення та накопичення в організмі гістаміну. Стан характеризується ураженням шкіри, порушенням серцевої діяльності і функції шлунково-кишкового тракту.
Особливе значення для медичної практики мають спадкові аміноацідопатіі, число яких на сьогодні становить близько 60 різних нозологічних форм. За типом успадкування майже всі вони відносяться до аутосомно-рецесивним. Патогенез обумовлений недостатністю того чи іншого ферменту, що здійснює катаболізм і анаболізм амінокислот. Загальним біохімічним ознакою аміноаіідопатій служить ацидоз тканин і аминоацидурия. Найбільш частими спадковими дефектами обміну є чотири види ензімопатії, які пов'язані між собою загальним шляхом метаболізму амінокислот: фенілкетонурія, тирозинемия, альбінізм, алкаптонурія.
Если ви нашли помилки, будь ласка, віділіть фрагмент тексту и натісніть Ctrl + Enter.


