- Йога начинающим видео
- Хулахуп танец видео
- Смотреть моя тренировка видео
- Видео тренировки александра емельяненко
- Как правильно крутить обруч на бедрах видео
- Тренировки в кудо видео
- Тренировки рой джонса видео
- Йога онлайн смотреть видео
- Тренировки костя дзю видео
- Видео тренировки роя джонса
- Видео спинальной
- Айенгар йога видео
- Йога для женщин на видео
- Правильно крутить обруч видео
- Плиометрические отжимания видео
- Новости

Управление Здравоохранения Евпаторийского городского совета (С)2011
67 гостей
бензол
Бенз про л, органічна сполука C6H6, найпростіший ароматичний вуглеводень ; рухлива безбарвна летюча рідина зі своєрідним нерізким запахом; tnл 5,5 ° C; t кіп 80,1 ° С; щільність 879,1 кг [м3 (0,8791 г / см3) при 20 ° С; n 20D 1,5011. З повітрям в об'ємній концентрації 1,5-8% Б. утворює вибухонебезпечні суміші. Б. змішується у всіх співвідношеннях з ефіром, бензином і ін. Органічними розчинниками; в 100 г Б. при 26 ° С розчиняється 0,054 г води; з водою утворює азеотропную (постійно киплячу) суміш (91,2% Б. по масі) з tkіп 69,25 ° С.
Б. відкритий М. Фарадеем . (1825), який виділив його з рідкого конденсату светильного газу; в чистому вигляді Б. отриманий в 1833 Е. Мічерліхом , Сухий перегонкою кальцієвої солі бензойної кислоти (звідси назва).
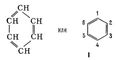
У 1865 Ф. А. Кекуле запропонував для Б. формулу будови I, відповідну ціклогексатріену - замкнутий ланцюг з 6 атомів вуглецю з чергуються простими і подвійними зв'язками. Формулою Кекуле досить широко користуються, хоча накопичено багато фактів, які свідчать про те, що Б. не володіє будовою ціклогексатріена. Так, давно встановлено, що орто-дізамещённие Б. (наприклад, 1,2 і 1,6) існують лише в одній формі, тоді як формула Кекуле допускає изомерию таких з'єднань (заступники у атомів вуглецю, пов'язаних простий або подвійним зв'язком). У 1872 Кекуле додатково ввів гіпотезу про те, що зв'язки в Б. постійно і дуже швидко переміщаються, осцилюють. Були запропоновані і ін. Формули будови Б., однак вони не отримали визнання.
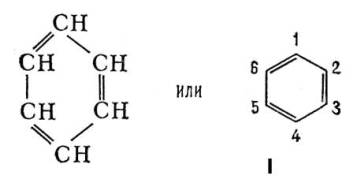
Хімічні властивості Б. формально в деякій мірі відповідають формулі (1). Так, в певних умовах до молекули Б. приєднуються 3 молекули хлору або 3 молекули водню; Б. утворюється при конденсації 3 молекул ацетилену. Однак для Б. характерні в основному не реакції приєднання, типові для ненасичених сполук, а реакції електрофільного заміщення. Крім того, бензольное ядро дуже стійко до дії окислювачів, наприклад перманганату калію, що також суперечить наявності в Б. локалізованих подвійних зв'язків. Особливі, т. Н. ароматичні, властивості Б. пояснюються тим, що всі зв'язки в його молекулі вирівняні, т. е. відстані між сусідніми атомами вуглецю однакові і рівні 0,14 нм (1,40 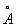 ), Довжина простий зв'язку С-С 0,154 нм (1,54
), Довжина простий зв'язку С-С 0,154 нм (1,54 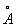 ) І подвійний С = С 0,132 нм (1,32
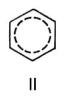
) І подвійний С = С 0,132 нм (1,32 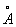 ). Молекула Б. має вісь симетрії шостого порядку; для Б. як ароматичного з'єднання характерна наявність секстету p-електронів, що утворюють єдину замкнуту стійку електронну систему. Однак до сих пір немає загальноприйнятої формули, що відбиває його будова; часто використовують формулу II.
). Молекула Б. має вісь симетрії шостого порядку; для Б. як ароматичного з'єднання характерна наявність секстету p-електронів, що утворюють єдину замкнуту стійку електронну систему. Однак до сих пір немає загальноприйнятої формули, що відбиває його будова; часто використовують формулу II.
Б. міститься в продуктах сухої перегонки кам'яного вугілля (коксовому газі) і невелика кількість - в коксової смолі. Значні кількості Б. отримують також каталітичної циклизацией аліфатичних вуглеводнів нафти (див. ароматизація нафтопродуктів ). Б. - найважливіша сировина хімічної промисловості. При дії азотної кислоти на Б. утворюється нітробензол С6Н5NО2, який може бути відновлений в анілін C6H5NH2 - вихідний продукт у виробництві багатьох барвників. При взаємодії Б. з сірчаною кислотою виходить бензолсульфокислота C6H5SO2OH, лужне плавлення солей якої - один з основних методів виробництва фенолу . При алкилировании Б. етиленом у присутності хлористого алюмінію виходить етилбензол, каталітичне дегідрування якого є основний спосіб виробництва стиролу C6H5CH = CH2. Аналогічно з Б. і пропилену утворюється ізопропілбензол C6H5CH (CH3) 2 - вихідний продукт для отримання фенолу і ацетону в промисловому масштабі. Широко застосовують і галогенопроїзводниє Б. Так, хлорбензол обмилюється в фенол; з хлорбензолу і магнію Гриньяра реакцією отримують фенілмагнійхлорід C6H5MgCI, при реакції якого з окисом етилену утворюється b -фенілетіловий спирт C6H5CH2CH2OH, який використовується в парфумерії як штучне рожеве масло. При каталітичному гідруванні Б. перетворюється в циклогексан - вихідний продукт в одному із способів виробництва капролактаму , Полімеризацією якого отримують синтетичне волокно «капрон». При опроміненні Б. приєднує 3 моля хлору з утворенням суміші стереоізомерних гексахлорциклогексану, один з яких (гексахлоран) володіє сильними інсектицидними властивостями. Б. застосовують у виробництві вибухових речовин, а також як розчинник і екстрагують засіб у виробництві лаків, фарб і ін.
Літ .: Неніцеську К. Д., Органічна хімія, пер. з рум., т. 1, М., 1962, с. 304, 323.
Я. Ф. Комісарів.
Дія на організм. Б. може викликати гострі і хронічні отруєння. Проникає в організм головним чином через органи дихання, може всмоктуватися і через неушкоджену шкіру. Гранично допустима концентрація парів Б. в повітрі робочих приміщень 20 мг / м3. Виводиться через легені і з сечею. Гострі отруєння відбуваються зазвичай при аваріях; їх найбільш характерні ознаки: головний біль, запаморочення, нудота, блювота, збудження, що змінюються пригнобленим станом, частий пульс, падіння кров'яного тиску, у важких випадках - судоми, втрата свідомості. Хронічне отруєння Б. виявляється зміною крові (порушення функції кісткового мозку), запамороченням, загальною слабкістю, розладом сну, швидкою стомлюваністю; у жінок - порушенням менструальної функції. Надійна міра проти отруєнь парами Б. - хороша вентиляція виробничих приміщень.
Лікування при гострих отруєннях: спокій, тепло, бромисті препарати, серцево-судинні засоби; при хронічних отруєннях з вираженою анемією: переливання еритроцитарної маси, вітамін B12, препарати заліза.
Літ .: Омельяненко Л. М. та Сенкевич Н. А., Клініка і профілактика отруєнь бензолом, М., 1957; Професійні хвороби, 2 видавництва., М., 1964.
Бензол.
Бензол.


