- Йога начинающим видео
- Хулахуп танец видео
- Смотреть моя тренировка видео
- Видео тренировки александра емельяненко
- Как правильно крутить обруч на бедрах видео
- Тренировки в кудо видео
- Тренировки рой джонса видео
- Йога онлайн смотреть видео
- Тренировки костя дзю видео
- Видео тренировки роя джонса
- Видео спинальной
- Айенгар йога видео
- Йога для женщин на видео
- Правильно крутить обруч видео
- Плиометрические отжимания видео
- Новости

Управление Здравоохранения Евпаторийского городского совета (С)2011
67 гостей
хлор
- Поширення в природі
- ізотопний склад
- Фізичні і фізико-хімічні властивості
- розчинність
- Хімічні властивості
- Взаємодія з металами
- Взаємодія з неметалами
- інші властивості
- Окисні властивості хлору
- Реакції з органічними речовинами
- Хлор способи отримання хлору
- Діафрагмовий метод з твердим катодом
- Ртутний метод з рідким катодом
- лабораторні методи
- зберігання хлору
- Стандарти якості хлору
- застосування
- Біологічна роль хлору
- Особливості роботи і запобіжні заходи
- Аналіз хлору, виявлення хлору - аналізується
- Хлорні запити, нас знаходять за запитами хлор
хлор атомний номер 17 Зовнішній вигляд простої речовини газ жовто-зеленого кольори з різким запахом . отруйний . властивості атома атомна маса
( молярна маса ) 35,4527 а.е.м. ( г / моль ) радіус атома 100 пм енергія іонізації
(Перший електрон) 1254.9 (13.01)
кДж / моль ( еВ ) Електронна конфігурація [Ne] 3s2 3p5 Хімічні властивості Ковалентний радіус 99 пм Радіус іона (+ 7e) 27 (-1e) 181 пм електронегативність
(по Полингу) 3.16 Електродний потенціал 0 Ступені окислення 7, 6, 5, 4, 3, 1, -1 Термодинамічні властивості Щільність (при -33.6 ° C) 1,56
г / см³ Питома теплоємність 21.838 Дж / ( K · моль ) теплопровідність 0.009 Вт / ( м · K ) Температура плавлення 172.2 K Теплота плавлення 6.41 кДж / моль Температура кипіння 238.6 K Теплота випаровування 20.41 кДж / моль Молярний об'єм 18.7 см ³ / моль Кристалічна ґратка Структура ґратки орторомбические Параметри решітки a = 6,29 b = 4,50 c = 8,21 Å Ставлення c / a - Температура Дебая n / a K CI 17 35,4527 [Ne] 3s23p5 Хлор
Хлор (χλωρός - зелений) - елемент головної підгрупи сьомої групи, третього періоду періодичної системи хімічних елементів Д. І. Менделєєва, з атомним номером 17. Позначається символом Cl (лат. Chlorum). Хімічно активний неметалл. Входить в групу галогенів (спочатку назва «галоген» використовував німецький хімік Швейгер для хлору [дослівно «галоген» перекладається як солерод], але воно не прижилося, і згодом стало загальним для VII групи елементів, в яку входить і хлор).
Проста речовина хлор (CAS-номер: 7782-50-5) при нормальних умовах - отруйний газ жовтувато-зеленого кольору, з різким запахом. Молекула хлору двухатомная (формула Cl2).
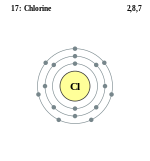
Схема атома хлору
Вперше хлор був отриманий в 1772 р Шеєле, який описав його виділення при взаємодії пиролюзита з соляною кислотою в своєму трактаті про піролюзиті:
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Шеєле зазначив запах хлору, схожий з запахом царської горілки, його здатність взаємодіяти з золотом і кіновар'ю, а також його відбілюючі властивості.
Однак Шеєле, відповідно до панувала в хімії того часу теорії флогістону, припустив, що хлор є дефлогістрованим соляну кислоту, тобто оксид соляної кислоти. Бертолле і Лавуазьє припустили, що хлор є оксидом елемента мурія, однак спроби його виділення залишалися безуспішними аж до робіт Деві, якому електролізом вдалося розкласти кухонну сіль на натрій і хлор.
Поширення в природі
У природі зустрічаються два ізотопу хлору 35Cl і 37Cl. У земній корі хлор найпоширеніший галоген. Хлор дуже активний - він безпосередньо з'єднується майже з усіма елементами періодичної системи. Тому в природі він зустрічається тільки у вигляді сполук в складі мінералів: Галіт NaCI, Сільвіна KCl, сильвініту KCl · NaCl, бішофіту MgCl2 · 6H2O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Найбільші запаси хлору містяться в складі солей вод морів і океанів.
На частку хлору доводиться 0,025% від загального числа атомів земної кори, кларки елементів хлору - 0,19%, а людський організм містить 0,25% іонів хлору по масі. В організмі людини і тварин хлор міститься в основному в міжклітинних рідинах (в тому числі в крові) і грає важливу роль в регуляції осмотичних процесів, а також в процесах, пов'язаних з роботою нервових клітин.
ізотопний склад
У природі зустрічаються 2 стабільних ізотопу хлору: з масовим числом 35 і 37. Частки їх змісту відповідно рівні 75,78% і 24,22%.
Ізотоп Відносна маса, а.е.м. Період напіврозпаду Тип розпаду Ядерний спін 35Cl 34.968852721 Стабільний - 3/2 36Cl 35.9683069 301000 років β-розпад в 36Ar 0 37Cl 36.96590262 Стабільний - 3/2 38Cl 37.9680106 37,2 хвилини β-розпад в 38Ar 2 39Cl 38.968009 55,6 хвилини β- розпад в 39Ar 3/2 40Cl 39.97042 1,38 хвилини β-розпад в 40Ar 2 41Cl 40.9707 34 c β-розпад в 41Ar 42Cl 41.9732 46,8 c β-розпад в 42Ar 43Cl 42.9742 3,3 c β-розпад в 43Ar
Фізичні і фізико-хімічні властивості
При нормальних умовах хлор - жовто-зелений газ з задушливим запахом. Деякі його фізичні властивості представлені в таблиці.
Деякі фізичні властивості хлору Властивість Значення Температура кипіння -34 ° C Температура плавлення -101 ° C Температура розкладання
(Дисоціації на атоми) ~ 1400 ° С Щільність (газ, н.у.) 3,214 г / л Спорідненість до електрону атома 3,65 еВ Перша енергія іонізації 12,97 еВ Теплоємність (298 К, газ) 34,94 (Дж / моль · K) Критична температура 144 ° C Критичне тиск 76 атм Стандартна ентальпія освіти (298 К, газ) 0 (кДж / моль) Стандартна ентропія освіти (298 К, газ) 222,9 (Дж / моль · K) Ентальпія плавлення 6,406 (кДж / моль) Ентальпія кипіння 20,41 (кДж / моль)
При охолодженні хлор перетворюється в рідину при температурі близько 239 К, а потім нижче 113 К кристалізується в орторомбические грати з просторовою групою Cmca і параметрами a = 6,29 Å b = 4,50 Å , C = 8,21 Å . Нижче 100 К орторомбические модифікація кристалічного хлору переходить в тетрагональную , Що має просторову групу P42 / ncm і параметри решітки a = 8,56 Å і c = 6,12 Å .
розчинність
Розчинник Розчинність г / 100 г бензол розчинний вода (0 ° C) 1,48 Вода (20 ° C) 0,96 Вода (25 ° C) 0,65 Вода (40 ° C) 0,46 Вода (60 ° C) 0,38 Вода (80 ° C) 0,22 тетрахлорметан (0 ° C) 31,4 Тетрахлорметан (19 ° C) 17,61 Тетрахлорметан (40 ° C) 11 хлороформ Добре розчинний TiCl4, SiCl4, SnCl4 Розчинний
ступінь дисоціації молекули хлору Cl2 → 2Cl. При 1000 К дорівнює 2,07 * 10-4%, а при 2500 К 0,909%.
Поріг сприйняття запаху в повітрі дорівнює 0,003 (мг / л).
У реєстрі CAS - номер 7782-50-5.
за електропровідності рідкий хлор займає місце серед найсильніших ізоляторів: він проводить струм майже в мільярд раз гірше, ніж дистильована вода , І в 1022 разів гірше срібла . швидкість звуку в хлорі приблизно в півтора рази менше, ніж в повітрі.
Хімічні властивості
Будова електронної оболонки
На валентном рівні атома хлору міститься 1 неспарених електрон : 1S² 2S² 2p6 3S² 3p5, тому валентність рівна 1 для атома хлору дуже стабільна. За рахунок присутності в атомі хлору незайнятої орбіталі d-підрівні, атом хлору може проявляти і інші валентності. Схема освіти збуджених станів атома:
Також відомі сполуки хлору, в яких атом хлору формально проявляє валентність 4 і 6, наприклад ClO2 і Cl2O6. Однак, ці сполуки є радикалами , Тобто у них є один неспарених електронів.
Взаємодія з металами
Хлор безпосередньо реагує майже з усіма металами (З деякими тільки в присутності вологи або при нагріванні):
Cl2 + 2Na → 2 NaCl 3Cl2 + 2Sb → 2SbCl3 3Cl2 + 2Fe → 2 FeCl3
Взаємодія з неметалами
C неметаллами (крім вуглецю , азоту , кисню і інертних газів ), Утворює відповідні хлориди .
На світлі або при нагріванні активно реагує (іноді з вибухом) з воднем по радикальному механізму. Суміші хлору з воднем, що містять від 5,8 до 88,3% водню, вибухають при опроміненні з утворенням хлороводню . Суміш хлору з воднем в невеликих концентраціях горить безбарвним або жовто-зеленим полум'ям. Максимальна температура воднево-хлорного полум'я 2200 ° C .:
Cl2 + H2 → 2HCl 5Cl2 + 2P → 2PCl5 2S + Cl2 → S2Cl2
З киснем хлор утворює оксиди в яких він проявляє ступінь окислення від +1 до +7: Cl2O, ClO2, Cl2O6, Cl2O7. Вони мають різкий запах, термічно і фотохімічно нестабільні, схильні до вибухового розпаду.
При реакції з фтором , Утворюється не хлорид, а фторид :
Cl2 + 3F2 (хат.) → 2 ClF3
інші властивості
хлор витісняє бром і йод з їх з'єднань з воднем і металами:
Cl2 + 2HBr → Br2 + 2HCl Cl2 + 2NaI → I2 + 2NaCl
При реакції з монооксидом вуглецю утворюється фосген :
Cl2 + CO → COCl2
При розчиненні в воді або лугах, хлор дісмутірует , утворюючи хлорноватистую (А при нагріванні хлорне ) і соляну кислоти , Або їх солі:
Cl2 + H2O → HCl + HClO 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
хлоруванням сухого гідроксиду кальцію отримують хлорне вапно :
Cl2 + Ca (OH) 2 → CaCl (OCl) + H2O
Дія хлору на аміак можна отримати трёххлорістий азот :
4NH3 + 3Cl2 → NCl3 + 3NH4Cl
Окисні властивості хлору
Хлор дуже сильний окислювач .
Cl2 + H2S → 2HCl + S
Реакції з органічними речовинами
З насиченими сполуками :
CH3-CH3 + Cl2 → C2H6-xClx + HCl
Приєднується до ненасичених сполук за кратними зв'язками:
CH2 = CH2 + Cl2 → Cl-CH2-CH2-Cl
Ароматичні сполуки заміщають атом водню на хлор в присутності каталізаторів (наприклад, AlCl3 або FeCl3):
C6H6 + Cl2 → C6H5Cl + HCl
Хлор способи отримання хлору
промислові методи
Спочатку промисловий спосіб отримання хлору грунтувався на методі Шеєле , Тобто реакції пиролюзита з соляною кислотою :
MnO2 + 4HCl → MnCl2 + Cl2 ↑ + 2H2O
В 1867 році Диконом був розроблений метод отримання хлору каталітичним окисленням хлороводню киснем повітря . Процес Дикона в даний час використовується при рекуперації хлору з хлороводню , Що є побічним продуктом при промисловому хлорування органічних сполук.
4HCl + O2 → 2H2O + 2Cl2
Сьогодні хлор в промислових масштабах отримують разом з гідроксидом натрію і воднем шляхом електролізу розчину кухонної солі :
2NaCl + 2H2О → H2 ↑ + Cl2 ↑ + 2NaOH анод : 2Cl- - 2е- → Cl20 ↑ катод : 2H2O + 2e- → H2 ↑ + 2OH-
Так як паралельно електролізу хлориду натрію проходить процес електроліз води, то сумарне рівняння можна виразити таким чином:
1,80 NaCl + 0,50 H2O → 1,00 Cl2 ↑ + 1,10 NaOH + 0,03 H2 ↑
Застосовується три варіанти електрохімічного методу отримання хлору. Два з них електроліз з твердим катодом: діафрагмовий і мембранний методи, третій - електроліз з рідким ртутним катодом (ртутний метод виробництва). У ряду електрохімічних методів виробництва найлегшим і зручним способом є електроліз з ртутним катодом, але цей метод завдає значної шкоди навколишньому середовищу в результаті випаровування і витоків металевої ртуті.
Діафрагмовий метод з твердим катодом
Порожнина електролізера розділена пористою азбестового перегородкою - діафрагмою - на катод і анодное простір, де відповідно розміщені катод і анод електролізера. Тому такий електролізер часто називають діафрагмовим, а метод отримання - діафрагмовим електролізом. У анодное простір диафрагменного електролізера безперервно надходить потік насиченого аноліта (розчину NaCl). В результаті електрохімічного процесу на аноді за рахунок розкладання Галіт виділяється хлор, а на катоді за рахунок розкладання води - водень. При цьому прікатодном зона збагачується гідроксидом натрію.
Мембранний метод з твердим катодом
Мембранний метод по суті, аналогічний діафрагмовому, але анодна і катодного простору розділені катіонообменной полімерною мембраною. Мембранний метод виробництва ефективніше, ніж діафрагмовий, але складніше в застосуванні.
Ртутний метод з рідким катодом
Процес проводять в електролітичній ванні, яка складається з електролізера, разлагателі і ртутного насоса, об'єднаних між собою комунікаціями. У електролітичної ванні під дією ртутного насоса циркулює ртуть, проходячи через електролізер і разлагателі. Катодом електролізера служить потік ртуті. Аноди - графітові або малоізнашівающіхся. Разом з ртуттю через електролізер безперервно тече потік аноліта - розчину хлориду натрію . В результаті електрохімічного розкладання хлориду на аноді утворюються молекули хлору, а на катоді виділився натрій розчиняється в ртуті утворюючи амальгаму .
лабораторні методи
У лабораторіях для отримання хлору зазвичай використовують процеси, засновані на окисленні хлороводню сильними окислювачами (наприклад, оксидом марганцю (IV) , перманганатом калію , дихроматом калію ):
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O K2Cr2O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2O
зберігання хлору
Вироблений хлор зберігається в спеціальних «танках» або закачується в сталеві балони високого тиску. Балони з рідким хлором під тиском мають спеціальне забарвлення - болотний колір. Слід зазначити що при тривалій експлуатації балонів з хлором в них накопичується надзвичайно вибуховий треххлорістий азот , І тому час від часу балони з хлором повинні проходити планову промивку та очищення від хлориду азоту.
Стандарти якості хлору
Згідно ГОСТ 6718-93 «Хлор рідкий. Технічні умови »робляться такі сорти хлору
Найменування показника ГОСТ 6718-93 Вищий сорт Перший сорт Об'ємна частка хлору, не менше,% 99,8 99,6 Масова частка води, не більше,% 0,01 0,04 Масова частка треххлористого азоту, не більше,% 0,002 0,004 Масова частка нелетучего залишку, не більше,% 0,015 0,10
застосування
Хлор застосовують в багатьох галузях промисловості, науки і побутових потреб:
- У виробництві полівінілхлориду , Пластикатів, синтетичного каучуку, з яких виготовляють: ізоляцію для проводів, віконний профіль, пакувальні матеріали , Одяг і взуття, лінолеум і грамплатівки, лаки, апаратуру і пінопласти , Іграшки, деталі приладів, будівельні матеріали. Полівінілхлорид виробляють полімеризацією вінілхлориду, який сьогодні найчастіше отримують з етилену збалансованим по хлору методом через проміжний 1,2-дихлоретан.
- Відбілюючі властивості хлору відомі з давніх часів, хоча не сам хлор «відбілює», а атомарний кисень, який утворюється при розпаді хлорнуватистої кислоти: Cl2 + H2O → HCl + HClO → 2HCl + O •. Цей спосіб відбілювання тканин, паперу, картону використовується вже кілька століть.
- Виробництво хлорорганічних інсектицидів - речовин, що вбивають шкідливих для посівів комах, але безпечні для рослин. На отримання засобів захисту рослин витрачається значна частина виробленого хлору. Один з найважливіших інсектицидів - гексахлорциклогексан (часто званий гексахлораном). Ця речовина вперше синтезовано ще в 1825 р Фарадеем, але практичне застосування знайшло тільки через 100 з гаком років - в 30-х роках нашого століття.
- використовувався як бойова отруйна речовина , А так само для виробництва інших бойових отруйних речовин: іприт , фосген .
- Для знезараження води - « хлорування ». Найбільш поширений спосіб знезараження питної води; заснований на здатності вільного хлору і його сполук пригнічувати ферментні системи мікроорганізмів каталізують окислювально-відновні процеси. Для знезараження питної води застосовують: хлор, двоокис хлору, хлорамін і хлорне вапно. СанПіН 2.1.4.1074-01 встановлює наступні межі (коридор) допустимого вмісту вільного залишкового хлору у питній воді централізованого водопостачання 0.3 - 0.5 мг / л. Ряд вчених і навіть політиків в Росії критикують саму концепцію хлорування водопровідної води, але альтернативи дезінфікуючій післядії сполук хлору запропонувати не можуть. Матеріали, з яких виготовлені водопровідні труби, по різному взаємодіють з хлорованою водопровідною водою. Вільний хлор у водопровідній воді істотно скорочує термін служби трубопроводів на основі поліолефінів : поліетиленових труб різного виду, в тому числі зшитого поліетилену, великі відомого як ПЕКС (PEX, PEX). У США для контролю допуску трубопроводів з полімерних матеріалів до використання в водогонах з хлорованою водою змушені були прийняти 3 стандарти: ASTM F2023 стосовно трубах із зшитого поліетилену (PEX) та гарячої хлорованій воді, ASTM F2263 стосовно до поліетиленових труб всім і хлорованій воді і ASTM F2330 стосовно багатошаровим (металополімерних) трубах і гарячої хлорованій воді. Позитивну реакцію в частині довговічності при взаємодії з хлорованою водою демонструють мідні труби.
- У харчовій промисловості зареєстрований як харчової добавки E925.
- У хімічному виробництві соляної кислоти , Хлорного вапна, бертолетової солі , хлоридів металів , Отрут, ліків, добрив.
- У металургії для виробництва чистих металів: титану, олова, танталу, ніобію.
- як індикатор сонячних нейтрино в хлор-аргонних детекторах.
Багато розвинених країн прагнуть обмежити використання хлору в побуті, в тому числі тому, що при спалюванні хлорсодержащего сміття утворюється значна кількість діоксинів .
Біологічна роль хлору
Хлор відноситься до найважливіших біогенних елементів і входить до складу всіх живих організмів.
У тварин і людини, іони хлору беруть участь у підтримці осмотичного рівноваги, хлорид-іон має оптимальний радіус для проникнення через мембрану клітин. Саме цим пояснюється його спільна участь з іонами натрію і калію в створенні постійного осмотичного тиску і регуляції водно-сольового обміну. Під впливом ГАМК (нейромедіатор) іони хлору надають гальмуючий ефект на нейрони шляхом зниження потенціалу дії . В шлунку іони хлору створюють сприятливе середовище для дії протеолітичних ферментів шлункового соку. Хлорні канали представлені в багатьох типах клітин, мітохондріальних мембранах і скелетних м'язах. Ці канали виконують важливі функції в регуляції об'єму рідини, трансепітеліальном транспорті іонів і стабілізації мембранних потенціалів, беруть участь в підтримці рН клітин. Хлор накопичується в вісцеральної тканини, шкірі і скелетних м'язах. Всмоктується хлор, в основному, в товстому кишечнику . Всмоктування і екскреція хлору тісно пов'язані з іонами натрію і бікарбонатами, в меншій мірі з мінералокортикоїдами і активністю Na + / K + - АТФ -ази. У клітинах акумулюється 10-15% всього хлору, з цієї кількості від 1/3 до 1/2 - в еритроцитах . Близько 85% хлору знаходяться в позаклітинному просторі. Хлор виводиться з організму в основному з сечею (90-95%), калом (4-8%) і через шкіру (до 2%). Екскреція хлору пов'язана з іонами натрію і калію, і реципрокно з HCO3- (кислотно-лужний баланс).
Людина споживає 5-10 г NaCl на добу. Мінімальна потреба людини в хлорі становить близько 800 мг на добу. Немовля отримує необхідну кількість хлору через молоко матері, в якому міститься 11 ммоль / л хлору. NaCl необхідний для вироблення в шлунку соляної кислоти, яка сприяє травленню і знищення хвороботворних бактерій. В даний час участь хлору у виникненні окремих захворювань у людини вивчено недостатньо добре, головним чином через малу кількість досліджень. Досить сказати, що не розроблені навіть рекомендації по нормі добового споживання хлору. М'язова тканина людини містить 0,20-0,52% хлору, кісткова - 0,09%; в крові - 2,89 г / л. В організмі середньої людини (маса тіла 70 кг) 95 г хлору. Щодня з їжею людина отримує 3-6 г хлору, що з надлишком покриває потребу в цьому елементі.
Іоні хлору жіттєво необхідні рослина. Хлор бере участь в Енергетичному обміні рослин, актівуючі окислительное фосфорилирование . ВІН необхідній для Утворення кисня в процесі фотосинтезу ізольованімі хлоропластами , Стімулює Допоміжні процеси фотосинтезу, дере за все ті з них, Які пов'язані з акумулюванням ЕНЕРГІЇ. Хлор позитивно впливає на поглинання коренями кисню, з'єднань калію, кальцію, магнію. Надмірна концентрація іонів хлору в рослинах може мати і негативний бік, наприклад, знижувати вміст хлорофілу , Зменшувати активність фотосинтезу, затримувати ріст і розвиток рослин .
Але існують рослини, які в процесі еволюції або пристосувалися до засолення грунтів, або в боротьбі за простір зайняли порожні солончаки на яких немає конкуренції. Рослини ростуть на засолених грунтах називаються - галофіти , Вони накопичують хлориди протягом вегетаційного сезону , А потім позбавляються від надлишків за допомогою листопада або виділяють хлориди на поверхню листя і гілок і отримують подвійну вигоду притіняючи поверхність від сонячного світла. У Росії галофіти виростають на соляних куполах, виходах соляних відкладень і засолених пониженнях навколо соляних озер Баскунчак , Ельтон .
Серед мікроорганізмів, так само відомі галофили - галобактеріі - які мешкають в сильносолених водах або грунтах.
Особливості роботи і запобіжні заходи
Хлор - токсичний задушливий газ, при попаданні в Легкі викликає опік легеневої тканини, задуху. Подразнюючу дію на дихальні шляхи надає при концентрації в повітрі близько 0,006 мг / л (тобто в два рази вище порога сприйняття запаху хлору). Хлор був одним з перших хімічних отруйних речовин, використаних Німеччиною в Першу світову війну. При роботі з хлором слід користуватися захисним спецодягом, протигазом, рукавичками. На короткий час захистити органи дихання від попадання в них хлору можна тряпичной пов'язкою, змоченою розчином сульфіту натрію Na2SO3 або тіосульфату натрію Na2S2O3.
ГДК хлору в атмосферному повітрі наступні: середньодобова - 0,03 мг / м³; максимально разова - 0,1 мг / м³; в робочих приміщеннях промислового підприємства - 1 мг / м³.
додаткова інформація
Виробництво хлору в Росії
хлорид золота
хлорне вода
хлорне вапно
Хлорид першого підстави Рейз
Хлорид другого підстави Рейз
сполуки хлору
гіпохлорити
перхлорати
хлорангидріди
хлорати
хлориди
хлорорганічні сполуки
Аналіз хлору, виявлення хлору - аналізується
- За допомогою аналітичного лабораторного устаткування, лабораторних і промислових електродів, зокрема: електродів порівняння ЕСР-10101 аналізують вміст Cl- і К +.
Хлорні запити, нас знаходять за запитами хлор
Взаємодія, отруєння, воді, реакції і отримання хлору
- оксид
- розчин
- кислоти
- з'єднання
- властивості
- визначення
- діоксид
- атом
- формула
- маса
- активний
- рідкий
- Речовини
- ! застосування
- дія
- ступінь окислення
- СОЛІ
- гідроксид


