- Йога начинающим видео
- Хулахуп танец видео
- Смотреть моя тренировка видео
- Видео тренировки александра емельяненко
- Как правильно крутить обруч на бедрах видео
- Тренировки в кудо видео
- Тренировки рой джонса видео
- Йога онлайн смотреть видео
- Тренировки костя дзю видео
- Видео тренировки роя джонса
- Видео спинальной
- Айенгар йога видео
- Йога для женщин на видео
- Правильно крутить обруч видео
- Плиометрические отжимания видео
- Новости

Управление Здравоохранения Евпаторийского городского совета (С)2011
67 гостей
карбонат натрію
- Спосіб Леблана [ правити | правити код ]
- Промисловий аміачний спосіб (спосіб Сольве) [ правити | правити код ]
- Спосіб Хоу [ правити | правити код ]
- Порівняння способів [ правити | правити код ]
карбонат натрію 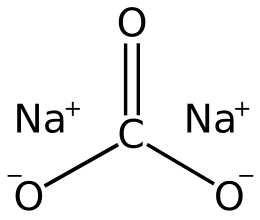
систематичне
найменування Карбонат натрію Традиційні назви кальцинована сода, вуглекислий натрій Хім. формула Na 2 C O 3 молярна маса 105,99 г / моль щільність 2,53 г / см³ Т. плав. 854 ° C 1000 ° C pKa 10,33 розчинність в воді при 20 ° C 21,8 г / 100 мл Реєстр. номер CAS 497-19-8 PubChem 10340 Реєстр. номер EINECS 207-838-8 SMILES InChI Кодекс Аліментаріус E500 (i) RTECS VZ4050000 ChEBI 29377 ChemSpider 9916 ЛД50 4 г / кг (щури, орально) піктограми СГС  NFPA 704 Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
NFPA 704 Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Карбонат натрію (кальцинована сода) - неорганічне з'єднання , натрієва сіль вугільної кислоти з хімічною формулою Na 2 C O 3. Безбарвні кристали або білий порошок, добре розчинний у воді. У промисловості в основному отримують з хлориду натрію за методом Солве. Застосовують при виготовленні скла, для виробництва миючих засобів, використовують у процесі отримання алюмінію з бокситів і при очищенні нафти.
Має вигляд безбарвних кристалів або білого порошку. Існує в декількох різних модифікаціях: α-модифікація з моноклінної кристалічною решіткою утворюється при температурі до 350 ° C, потім, при нагріванні вище цієї температури і до 479 ° C здійснюється перехід в β-модифікацію, також має моноклинную кристалічну решітку. При збільшенні температури вище 479 ° C з'єднання переходить γ-модифікацію з гексагональної гратами. Плавиться при 854 ° C, при нагріванні понад 1000 ° C розкладається з утворенням оксиду натрію і діоксиду вуглецю [1] [2] .
Кристалогідрати карбонату натрію існують в різних формах: безбарвний моноклінний Na2CO3 · 10H2O, при 32,017 ° C переходить в безбарвний ромбічний Na2CO3 · 7H2O, останній при нагріванні до 35,27 ° C безбарвний переходить в ромбічний Na2CO3 · H2O. В інтервалі 100-120 ° C моногідрат втрачає воду.
Властивості карбонату натрію Параметр Безводний карбонат натрію декагідрат Na2CO3 · 10H2O Молекулярна маса 105,99 а. е. м. 286,14 а. е. м. Температура плавлення 854 ° C 32 ° C Розчинність Нерозчинний в ацетоні , І сероуглероде, малорастворим в етанолі , Добре розчинний в гліцерині і воді Щільність ρ 2,53 г / см³ (при 20 ° C) 1,446 г / см³ (при 17 ° C) Стандартна ентальпія освіти ΔH -1131 кДж / моль (т) (при 297 К) -4083,5 кДж / моль ((т) (при 297 К) Стандартна енергія Гіббса освіти G -1047,5 кДж / моль (т) (при 297 К) -3242,3 кДж / моль ((т) (при 297 К) Стандартна ентропія освіти S 136,4 Дж / моль · K (т) (при 297 К) Стандартна мольна теплоємність Cp 109,2 Дж / моль · K (ЖГ) (при 297 К) Розчинність карбонату натрію в воді температура , ° C 0 10 20 25 30 40 50 60 80 100 120 140 розчинність , Г Na2CO3 на 100 г H2O 7 12,2 21,8 29,4 39,7 48,8 47,3 46,4 45,1 44,7 42,7 39,3
У водному розчині карбонат натрію гідролізується , Що забезпечує лужну реакцію середовища. Рівняння гідролізу (в іонної формі):
CO 3 2 - + H 2 O ⇄ HCO 3 - + OH - {\ displaystyle {\ mathsf {CO_ {3} ^ {2 -} + H_ {2} O \ rightleftarrows HCO_ {3} ^ {-} + OH ^ {-}}}}
перша константа дисоціації вугільної кислоти дорівнює 4,5⋅10-7. Всі кислоти, більш сильні, ніж вугільна, витісняють її в реакції з карбонатом натрію. Так як вугільна кислота вкрай нестійка, вона тут же розкладається на воду і вуглекислий газ:
N a 2 CO 3 + H 2 SO 4 → N a 2 SO 4 + H 2 O + CO 2 ↑ {\ displaystyle {\ mathsf {Na_ {2} CO_ {3} + H_ {2} SO_ {4} \ rightarrow Na_ {2} SO_ {4} + H_ {2} O + CO_ {2} \ uparrow}}}
У природі сода зустрічається в золі деяких морських водоростей, а також у вигляді мінералів:
Сучасні содові озера відомі в Забайкаллі і в Західного Сибіру ; великою популярністю користується озеро Натрон в Танзанії і озеро Сірлс в Каліфорнії [3] [ неавторитетний джерело? ]. Трону, що має промислове значення, відкрита в 1938 в складі еоценову товщі Грін-Рівер ( Вайомінг , США ). Разом з трону в цій осадової товщі виявлено багато раніше вважалися рідкісними мінералів, в тому числі Давсон , Який розглядається як сировину для отримання соди і глинозему . У США природна сода задовольняє більше 40% потреби країни в цій корисній копалині.
До початку XIX століття карбонат натрію отримували переважно з золи деяких морських водоростей, прибережних і солонцюватих рослин шляхом перекристалізації щодо малорастворимого NaHCO3 з лугу .
Спосіб Леблана [ правити | правити код ]
У 1791 році французький хімік Нікола Леблан отримав патент на «Спосіб перетворення глауберової солі в соду ». За цим способом при температурі близько 1000 ° C запікається суміш сульфату натрію ( «Глауберової солі»), крейди або вапняку ( карбонату кальцію ) і деревного вугілля . Вугілля відновлює сульфат натрію до сульфіду:
N a 2 S O 4 + 2 C → N a 2 S + 2 C O 2 {\ displaystyle {\ mathsf {Na_ {2} SO_ {4} + 2C \ rightarrow Na_ {2} S + 2CO_ {2}}}}
Сульфід натрію реагує з карбонатом кальцію:
N a 2 S + C a CO 3 → N a 2 CO 3 + C a S {\ displaystyle {\ mathsf {Na_ {2} S + CaCO_ {3} \ rightarrow Na_ {2} CO_ {3} + CaS}} }
Отриманий розплав обробляють водою, при цьому карбонат натрію переходить в розчин, сульфід кальцію відфільтровують, потім розчин карбонату натрію упаривают. Сиру соду очищають перекристаллизацией . Процес Леблана дає соду у вигляді кристалогідрату (див. Вище), тому отриману соду зневоднюють кальцинуванням.
Сульфат натрію отримували обробкою кам'яної солі ( хлориду натрію ) сірчаною кислотою :
2 N a C l + H 2 SO 4 → N a 2 SO 4 + 2 HC l {\ displaystyle {\ mathsf {2NaCl + H_ {2} SO_ {4} \ rightarrow Na_ {2} SO_ {4} + 2HCl} }}
Виділявся в ході реакції хлороводород вловлювали водою з отриманням соляної кислоти .
Перший содовий завод такого типу в Росії був заснований промисловцем М. Пранг і з'явився в Барнаулі в 1864 році .
Після появи більш економічного (не залишається в великих кількостях побічний сульфід кальцію) і технологічного способу Сольве, заводи, що працюють за способом Леблана, стали закриватися. До 1900 році 90% підприємств виробляли соду за методом Сольве, а останні фабрики, що працюють за методом Леблана, закрилися на початку 1920-х.
Промисловий аміачний спосіб (спосіб Сольве) [ правити | правити код ]
В 1861 році бельгійський інженер-хімік Ернест Сольве запатентував метод виробництва соди, який використовується і до цього дня.
В насичений розчин хлориду натрію пропускають еквімолярних кількості газоподібних аміаку і діоксиду вуглецю , Тобто як би вводять гідрокарбонат амонію NH4HCO3:
NH 3 + CO 2 + H 2 O + N a C l → N a HCO 3 + NH 4 C l {\ displaystyle {\ mathsf {NH_ {3} + CO_ {2} + H_ {2} O + NaCl \ rightarrow NaHCO_ {3} + NH_ {4} Cl}}}
Випав залишок малорастворимого (9,6 г на 100 г води при 20 ° C) бікарбонату натрію відфільтровують і КАЛЬЦИНУЮЧА (зневоднюють) нагріванням до 140-160 ° C, при цьому він переходить в карбонат натрію:
2 N a HCO 3 → ot N a 2 CO 3 + H 2 O + CO 2 ↑ {\ displaystyle {\ mathsf {2NaHCO_ {3} {\ xrightarrow [{}] {^ {o} t}} Na_ {2} CO_ {3} + H_ {2} O + CO_ {2} \ uparrow}}}
Утворився CO2 повертають у виробничий цикл. Хлорид амонію NH4Cl обробляють гідроксидом кальцію Ca (OH) 2:
2 NH 4 C l + C a (OH) 2 → C a C l 2 + 2 NH 3 + 2 H 2 O {\ displaystyle {\ mathsf {2NH_ {4} Cl + Ca (OH) _ {2} \ rightarrow CaCl_ {2} + 2NH_ {3} + 2H_ {2} O}}}
Отриманий NH3 також повертають у виробничий цикл.
Таким чином, єдиним відходом виробництва є хлорид кальцію .
Перший содовий завод такого типу в світі був відкритий в 1863 в Бельгії ; перший завод такого типу в Росії був заснований в районі уральського міста Березники фірмою «Любимов, Сольве і Ко» в 1883 році . Його продуктивність становила 20 тисяч тонн соди в рік. У 2010 році ФАС Росії відмовила фірмі Solvay в покупці цього заводу, дозволивши покупку групі Башкирська хімія (їй також належить завод Сода). [ Джерело не вказано 2686 днів ]
До сих пір цей спосіб залишається основним способом отримання соди в усіх країнах.
Спосіб Хоу [ правити | правити код ]
Розроблено китайським хіміком Хоу ( Hou Debang ) В 1930-х роках. Відрізняється від процесу Сольве тим, що не використовує гідроксид кальцію.
За способом Хоу в розчин хлориду натрію при температурі 40 градусів подається діоксид вуглецю і аміак. Менш розчинний гідрокарбонат натрію в ході реакції випадає в осад (як і в методі Сольве). Потім розчин охолоджують до 10 градусів. При цьому випадає в осад хлорид амонію, а розчин використовують повторно для виробництва наступних порцій соди.
Порівняння способів [ правити | правити код ]
За методом Хоу в якості побічного продукту утворюється NH4Cl замість CaCl2 за методом Сольве.
Спосіб Сольве був розроблений до появи процесу Габера , В той час аміак був в дефіциті, тому регенерувати його з NH4Cl було необхідно. Метод Хоу з'явився пізніше, необхідність регенерації аміаку вже не стояла так гостро, відповідно, аміак можна було не витягувати, а використовувати його як азотне добриво у вигляді з'єднання NH4Cl.
Проте NH4Cl містить хлор, надлишок якого шкідливий для багатьох рослин, тому використання NH4Cl в якості добрива обмежено. У свою чергу рис добре переносить надлишок хлору, і в Китаї, де застосовується NH4Cl для рисівництва, метод Хоу, що дає NH4Cl в якості побічного продукту, більш широко представлений в порівнянні з іншими регіонами.
В даний час в ряді країн практично весь штучно виготовляється карбонат натрію виробляється за методом Сольве (включаючи метод Хоу як модифікацію), а саме в Європі 94% штучно виробленої соди, у всьому світі - 84% (2000 рік) [4] .
Карбонат натрію використовують у скляному виробництві; миловарінні і виробництві пральних і чистячих порошків ; емалей , для отримання ультрамарину . Також він застосовується для пом'якшення води парових котлів і взагалі зменшення жорсткості води , Для знежирення металів і десульфатізаціі доменного чавуну . Карбонат натрію - вихідний продукт для отримання NaOH , Na2B4O7, Na2HPO4. Може використовуватися в сигаретних фільтрах [5] .
У харчовій промисловості карбонати натрію зареєстровані як харчової добавки E500 , - регулятора кислотності, розпушувача, що перешкоджає злежуванню і злежування. Карбонат натрію (кальцинована сода, Na2CO3) має код 500i, гідрокарбонат натрію (Харчова сода, NaHCO3) - 500ii, їх суміш - 500iii.
Одна з новітніх технологій підвищення нафтовіддачі пластів - АСП заводнення, в якому застосовується сода в поєднанні з ПАР для зниження міжфазного натягу між водою і нафтою .
У фотографії використовується в складі проявителей як прискорює засіб [6] .
Самостійно додається в моторне масло для запобігання полімеризації. Концентрація 2 г на 1 л масла.
Гранично допустима концентрація аерозолі кальцинованої соди в повітрі виробничих приміщень - 2 мг / м3 [1] . Кальцинована сода відноситься до речовин 3-го класу небезпеки. Аерозоль кальцинованої соди при попаданні на вологу шкіру і слизові оболонки очей і носа може викликати роздратування, а при тривалому впливі її - дерматит.
Сода - загальна назва технічних натрієвих солей вугільної кислоти .
- Na2CO3 (карбонат натрію) - кальцинована сода, Білизна сода
- Na2CO3 · 10H2O (декагідрат карбонату натрію, містить 62,5% кристалізаційної води) - пральна сода; іноді випускається у вигляді Na2CO3 · H2O або Na2CO3 · 7H2O
- NaHCO3 ( гідрокарбонат натрію ) - харчова сода, натрій двовуглекислий (устар.), Бікарбонат натрію
«Сода» в європейських мовах відбувається, ймовірно, від арабського «suwwad» - загальна назва різних видів солянок , Рослин, з золи яких її добували в середні століття; існують і інші версії [7] . Кальцинована сода (карбонат натрію) називається так тому, що для отримання її з бікарбонату останній «КАЛЬЦИНУЮЧА» (лат. Calcinatio, від calx, за подібністю з процесом випалу вапна ), Тобто прокаливают.


