- Йога начинающим видео
- Хулахуп танец видео
- Смотреть моя тренировка видео
- Видео тренировки александра емельяненко
- Как правильно крутить обруч на бедрах видео
- Тренировки в кудо видео
- Тренировки рой джонса видео
- Йога онлайн смотреть видео
- Тренировки костя дзю видео
- Видео тренировки роя джонса
- Видео спинальной
- Айенгар йога видео
- Йога для женщин на видео
- Правильно крутить обруч видео
- Плиометрические отжимания видео
- Новости

Управление Здравоохранения Евпаторийского городского совета (С)2011
67 гостей
молярна концентрація
- Масова частка (також називають процентною концентрацією)
- об'ємна частка
- Молярность (молярна об'ємна концентрація)
- Моляльность (молярна вагова концентрація)
- Нормальна концентрація (мольна концентрація еквівалента)
- титр розчину
- молярна частка
- Інші способи вираження концентрації розчинів
- Застосування способів вираження концентрації розчинів, їх властивості
- Формули переходу від одних виразів концентрацій розчинів до інших
Концентрація - величина, що характеризує кількісний склад розчину .
Згідно правил ІЮПАК , Концентрацією розчиненої речовини (не розчиниться) називають відношення кількості розчиненої речовини або його маси до обсягом розчину (моль / л, г / л), тобто це співвідношення неоднорідних величин.
Ті величини, які є відношенням однотипних величин (відношення маси розчиненої речовини до маси розчину, відношення обсягу розчиненої речовини до об'єму розчину) правильно називати частками. Однак на практиці для обох видів вираження складу застосовують термін концентрація і говорять про концентрацію розчинів.
Існує багато способів вираження концентрації розчинів.
Масова частка (також називають процентною концентрацією)
Масова частка - відношення маси розчиненої речовини до маси розчину. Масова частка вимірюється в частках одиниці.
де:
- m1 - маса розчиненої речовини, г (кг);
- m - загальна маса розчину, г (кг).
Масове процентний вміст компонента, m%
m% = (mi / Σmi) * 100
У бінарних розчинах часто існує однозначна залежність між щільністю розчину і його концентрацією (при даній температурі). Це дає можливість визначати на практиці концентрації важливих розчинів за допомогою денсиметра ( спірометра , Сахариметра, лактометра). Деякі ареометри проградуйовані не в значеннях щільності, а безпосередньо концентрації розчину ( спирту , жиру в молоці, цукру). Слід враховувати, що для деяких речовин крива щільності розчину має максимум, в цьому випадку проводять 2 вимірювання: безпосереднє, і при невеликому розведенні розчину.
Часто для вираження концентрації (наприклад, сірчаної кислоти в акумуляторних) користуються просто їх щільністю. поширені ареометри (Денсиметри, густиноміри), призначені для визначення концентрації розчинів речовин.
Приклад. Залежність щільності розчинів H2SO4 від її масової частки у водному розчині при 20 ° C ω,% 5 10 15 20 30 40 50 60 70 80 90 95 ρ H2SO4, г / мл 1,032 1,066 1,102 1,139 1,219 1,303 1,395 1,498 1,611 1,727 1,814 1,834
об'ємна частка
Об'ємна частка - відношення обсягу розчиненої речовини до об'єму розчину. Об'ємна частка вимірюється в частках одиниці або у відсотках.
де:
- V1 - обсяг розчиненої речовини, л;
- V - загальний об'єм розчину, л.
Як було зазначено вище, існують ареометри, призначені для визначення концентрації розчинів певних речовин. Такі ареометри проградуйовані не в значеннях щільності, а безпосередньо концентрації розчину. Для поширених розчинів етилового спирту , Концентрація яких зазвичай виражається в об'ємних відсотках, такі ареометри отримали назву спиртоміри.
Молярность (молярна об'ємна концентрація)
Молярна концентрація - число молей розчиненої речовини в одиниці об'єму розчину. Молярна концентрація в системі СІ вимірюється в моль / м3, однак на практиці її набагато частіше висловлюють в моль / л або ммоль / л. Також поширене вираз в «молярности». Можливо інше позначення молярної концентрації-С (х), яке прийнято позначати М. Так, розчин з концентрацією 0,5 моль / л називають 0,5-молярним.
де:
Моляльность (молярна вагова концентрація)
Моляльность - число молей розчиненої речовини в 1000 г розчинника. Вимірюється в молях на кг, також поширене вираз в «молекулярний». Так, розчин з концентрацією 0,5 моль / кг називають 0,5-молекулярний.
де:
Слід звернути особливу увагу, що незважаючи на схожість назв, молярна концентрація і моляльність - величини різні. Перш за все, на відміну від молярної концентрації, при вираженні концентрації в молекулярний розрахунок ведуть на масу розчинника, а не на обсяг розчину. Моляльность, на відміну від молярної концентрації, не залежить від температури.
Нормальна концентрація (мольна концентрація еквівалента)
Нормальна концентрація - кількість еквівалентів даної речовини в 1 літрі розчину. Нормальну концентрацію висловлюють в моль / л (мається на увазі моль еквівалентів). Для запису концентрації таких розчинів використовують скорочення «н» або «N». Наприклад, розчин містить 0,1 моль / л, називають децінормального і записують як 0,1 н.
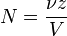
де:
Нормальна концентрація може відрізнятися в залежності від реакції, в якій бере участь речовина. Наприклад, одномолярний розчин H2SO4 буде однонормальним, якщо він призначається для реакції з лугом з утворенням гідросульфату KHSO4, і двухнормальним в реакції з утворенням K2SO4.
титр розчину
Титр розчину - маса розчиненої речовини в 1 мл розчину.
де:
- m1 - маса розчиненої речовини, г;
- V - загальний об'єм розчину, мл;
В аналітичної хімії зазвичай концентрацію титранту перераховують стосовно конкретної реакції титрування таким чином, щоб обсяг використаного титранту безпосереднього показував масу визначається речовини; тобто титр розчину показує, якій масі визначається речовини (в грамах) відповідає 1 мл титруватирозчину.
молярна частка
Молярна частка - відношення кількості молей даного компонента до загальної кількості молей всіх компонентів. Мольную частку виражають в частках одиниці.
де:
- νi - кількість i-го компонента, моль;
- n - число компонентів;
Інші способи вираження концентрації розчинів
Існують і інші, поширені в певних галузях знань чи технологіях, способи вираження концентрації. Наприклад, в фотометрії часто використовують масову концентрацію, рівну масі розчиненої речовини в 1 л розчину. При приготуванні розчинів кислот часто вказують, скільки об'ємних частин води доводиться на одну об'ємну частину концентрованої кислоти (наприклад, 1: 3). Концентрація забруднень в повітрі може виражатися в частинах на мільйон (
Застосування способів вираження концентрації розчинів, їх властивості
У зв'язку з тим, що моляльність, масова частка, молярна частка не включають в себе значення обсягів, концентрація таких розчинів залишається незмінною при зміні температури. Молярность, об'ємна частка, титр, нормальність змінюються при зміні температури, тому що при цьому змінюється щільність розчинів.
Різні види вираження концентрації розчинів застосовуються в різних сферах діяльності, відповідно до зручністю застосування і приготування розчинів заданих концентрацій. Так, титр розчину зручний в аналітичній хімії для волюмометрії (титриметрического аналізу) і т.п.
Формули переходу від одних виразів концентрацій розчинів до інших
Найбільш поширені одиниці
Wikimedia Foundation. 2010 року.


