- Йога начинающим видео
- Хулахуп танец видео
- Смотреть моя тренировка видео
- Видео тренировки александра емельяненко
- Как правильно крутить обруч на бедрах видео
- Тренировки в кудо видео
- Тренировки рой джонса видео
- Йога онлайн смотреть видео
- Тренировки костя дзю видео
- Видео тренировки роя джонса
- Видео спинальной
- Айенгар йога видео
- Йога для женщин на видео
- Правильно крутить обруч видео
- Плиометрические отжимания видео
- Новости

Управление Здравоохранения Евпаторийского городского совета (С)2011
67 гостей
Забруднюючі речовини 3 класу небезпеки - Челябінський гідрометеоцентр
> моніторинг середовища > Забруднюючі речовини > Забруднюючі речовини 3 класу небезпеки
Пил. Зважені речовини.

Пил - це вид аерозолю, дисперсна система, що складається з дрібних твердих частинок, що знаходяться в підвішеному стані в газовому середовищі. Окремі частки або їх скупчення, від ультрамікроскопічних до видимих неозброєним оком, можуть мати будь-яку форму і склад. У більшості випадків пил утворюється в результаті диспергування твердих тіл і включає частки різних розмірів, переважно в межах 10-7-10-4 м. Вони можуть нести електрично заряд або бути електронейтральності. Концентрацію пилу (запиленість) висловлюють числом частинок або їх загальною масою в одиниці об'єму газу (повітря). Пил нестійка: її частки з'єднуються в процесі броунівського руху або при осіданні (седиментації).
Види промислового пилу:
1. Механічна пил.
Промислова пил, що утворюється в результаті подрібнення продукту в ході технологічного процесу.
2. возгонов.
Промислова пил, що утворюється в результаті об'ємної конденсації парів речовин при охолодженні газу, що пропускається через технологічний апарат, установку або агрегат.
3. Летюча зола.
Промислова пил у вигляді вогнетривкої залишку палива, що утворюється з його мінеральних домішок при горінні, що міститься в димовому газі в підвішеному стані.
4. Промислова сажа.
Дисперсний вуглецевий продукт неповного згоряння або термічного розкладання вуглеводнів, що складається з сферичних частинок чорного кольору. Середній розмір часток саж - 100-3500. Частинки сажі утворені з шарів вуглецевих атомів, подібних верствам в графіті. Ці шари складаються з шестикутників, в вершинах яких знаходяться атоми вуглецю, але, на відміну від графіту, шари в сажі не плоскі, а вигнуті, що обумовлює сферичну поверхню частинок. Щільність часток саж близько 2 г / см3. Поверхня частинок в сажі може бути шорсткою або гладкою.
Пил і сажа відносяться до 3 класу небезпеки.
ГДК речовини, мг / м3.
Максимальна разова - 0,150
Середньодобова - 0,05
Джерела надходження пилу в атмосферу.
В повітрі містяться частинки пилу і сажі, що виникає в результаті вивітрювання гірських порід, вулканічних вивержень, пожеж, вітрової ерозії орних земель, виробничої діяльності людини. Пил, як і інші види аерозолів, підсилює розсіяння і поглинання світла атмосферою, впливає на її тепловий режим.
Постійні джерела підвищеної запиленості - галузі металургійного, хімічного та текстильного виробництва, будівництво і деякі галузі народного господарства (рільництво), багато транспортних засобів.
Джерелами викидів сажі в атмосферу є дизелі, авіаційні турбіни, теплові енергетичні установки, лісові пожежі та ін. Концентрація часток саж над океанами становить 0,5 мкг / м3, а в приземному шарі промислово розвинених районів вона досягає 30 мкг / м3.
Сажа утворюється при горінні в промислових і побутових печах, при роботі двигунів внутрішнього згоряння (дизелях), викидається разом з продуктами горіння в атмосферу у вигляді шкідливих димів.
Сажеві частки не взаємодіють з киснем повітря, тому видаляються тільки за рахунок коагуляції і осадження, які йдуть досить повільно.
Основними джерелами штучних аерозольних забруднень повітря є ТЕС, які споживають вугілля високої зольності, збагачувальні фабрики, металургійні, цементні, магнезитові і сажеві заводи. Аерозольні частинки від цих джерел відрізняються більшою розмаїтістю хімічного складу. Найчастіше в їхньому складі виявляються сполуки кремнію, кальцію і вуглецю, рідше - оксиди металів: заліза, магнію, марганцю, цинку, міді, нікелю, свинцю, сурми, вісмуту, селену, миш'яку, берилію, кадмію, хрому, кобальту, молібдену, а також азбест. Вони містяться в викидах підприємств теплоенергетики, чорної і кольорової металургії, будматеріалів, а також автомобільного транспорту. Пил, брали в облогу в індустріальних районах, містить до 20% оксиду заліза, 15% силікатів і 5% сажі, а також домішки різних металів (свинець, ванадій, молібден, миш'як, сурма і т.д.).
Ще більша розмаїтість властива органічному пилу, що включає аліфатичні і ароматичні вуглеводні, солі кислот. Вона утворюється при спалюванні залишкових нафтопродуктів, у процесі піролізу на нафтопереробних, нафтохімічних і інших подібних підприємствах. Постійними джерелами аерозольного забруднення є промислові відвали-штучні насипи з перевідкладеного матеріалу, переважно розкривних порід, утворених при видобутку корисних копалин або ж з відходів підприємств перерабативаюшей промисловості, ТЕС.
Джерелом пилу й отруйних газів служать масові вибухові роботи. Так, в результаті одного середнього по масі вибуху (250-300 тонн вибухових речовин) в атмосферу викидається близько 2 тисяч м3 умовного оксиду вуглецю і більше 150 тонн пилу.
Виробництво цементу та інших будівельних матеріалів також є джерелом забруднення атмосфери пилом. Основні технологічні процеси цих виробництв - подрібнення і хімічна обробка шихт, напівфабрикатів і одержуваних продуктів у потоках гарячих газів завжди супроводжується викидами пилу й інших шкідливих речовин в атмосферу.
Концентрація аерозолів змінюється в досить широких межах: від 10 мг / м3 у чистій атмосфері до 2.10 мг / м3 в індустріальних районах. Концентрація аерозолів в індустріальних районах і великих містах з інтенсивним автомобільним рухом в сотні разів вище, ніж у сільській місцевості. Серед аерозолів антропогенного походження особливу небезпеку для біосфери представляє свинець, концентрація якого змінюється від 0,000001 мг / м3 для незаселених районів до 0,0001 мг / м3 для призначених для забудови територій. У містах концентрація свинцю значно вище - від 0,001 до 0,03 мг / м3.
Вплив на живі організми.
Пилові частинки поглинають короткохвильові частини сонячного спектра, знижують кількість досягає земної поверхні ультрафіолету, що сприяє ослабленню адаптивних властивостей всіх живих організмів. Вони осідають на поверхні листя рослин, скорочуючи їх здатність до сприйняття сонячного світла.
Сажеві частки в силу своєї розгалуженої поверхні здатні адсорбувати значні кількості різних сполук, включаючи полиароматические. Таким чином, сажа грає важливу роль в перенесенні шкідливих сполук в атмосфері.
Тривалий контакт з сажею викликає рак шкіри, загострюються респіраторні захворювання, стоншується слизова верхніх дихальних шляхів.
За даними Всесвітньої організації охорони здоров'я при концентрації пилу в атмосферному повітрі 0,08 мг / м3, відчувається дискомфорт у людей. При подальшому збільшенні вмісту пилу до 0,25-0,5 мг / м3 спостерігається погіршення стану хворих з легеневими захворюваннями. Постійне перебування людей в атмосфері з концентрацією пилу вище 0,5 мг / м3 призводить до більш частих захворювань і зростанню смертності.
Діоксид сірки.
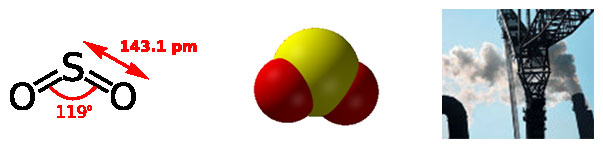
У нормальних умовах діоксид сірки - безбарвний газ з характерним різким запахом (запах загорающейся сірники). Розчинність газу у воді - досить велика.
Діоксид сірки - реакційно-здатний, через хімічних перетворень час його життя в атмосфері - невелика (близько декількох годин). У зв'язку з цим можливості забруднення і небезпека впливу безпосередньо діоксиду сірки носять локальний, а в окремих випадках - регіональний характер.
Природні і антропогенні джерела надходження в навколишнє середовище.
До природних (природних) джерел діоксиду сірки відносять вулкани, лісові пожежі, морська піна і мікробіологічні перетворення сірковмісних сполук. Вирізняється в атмосферу діоксид сірки може зв'язуватися вапном, в результаті чого в повітрі підтримується його постійна концентрація близько 1 млн-1.
Діоксид сірки антропогенного походження утворюється при згорянні вугілля і нафти, в металургійних виробництвах, при переробці містять сірку руд (сульфіди), при різних хімічних технологічних процесах. Велика частина антропогенних викидів діоксиду сірки (близько 87%) пов'язана з енергетикою і металургійною промисловістю. Загальна кількість антропогенного діоксиду сірки, що викидається за рік перевищує його природне утворення в 20-30 разів.
Щорічне надходження сірчистого газу в атмосферу тільки внаслідок промислових викидів оцінюється майже в 150 млн. Т.
Поведінка в атмосфері.
Час перебування діоксиду сірки в атмосфері в середньому обчислюється двома тижнями. Цього часу мало для того, щоб газ міг поширитися в глобальному масштабі. Тому, в сусідніх географічних районах, де здійснюються як великі, так і помірні викиди діоксиду сірки, в атмосфері може спостерігатися велика різниця концентрацій діоксиду сірки.
Легкорозчинний у воді, утворює кислоту газ, може розноситися потужними потоками повітря на сотні кілометрів (до 1500 км). При цьому в хмарах йде реакція освіти кислот і можливе випадання кислотних дощів.
Під час перенесення діоксиду сірки та інші кислотні викиди лише в дуже малому ступені втрачають свою активність. Нейтралізація відбувається тільки в тому випадку, якщо в повітрі одночасно з діоксидом сірки знаходиться пил, що містить гідроксиди лужних і лужноземельних елементів. Атмосфера очищається, головним чином, при вимиванні кислих газів водою і снігом, а також при їх «сухому» осадженні, тобто у вигляді самого газу або адсорбованого на найдрібніших частинках пилу. Крім того, діоксид сірки розчиняється в найдрібніших крапельках туману, які після осадження також відносять до сухої частини забруднень.
Суха частина забруднень зазвичай випадає або в безпосередній близькості від джерела викидів, або на незначній відстані від нього. При тривалому перенесення повітрям в основному випадає пов'язана водою частину викидів.
В атмосфері діоксид сірки зазнає ряд хімічних перетворень, найважливіші з них - окислення і утворення кислоти.
Окислення може проходити різними шляхами і в силу різних причин. Наприклад, УФ-випромінювання може перевести молекулу діоксиду сірки в збуджений стан, при довжині хвилі менше 320 нм - в синглетное збуджений стан, при довжині хвилі 320-390 нм в триплетное. Молекули діоксиду сірки, що знаходяться в тріплетном стані, реагують з киснем повітря і через радикали SO42- перетворюються в молекули SO3.
Більше значення все ж має окислення за допомогою радикалів ОН. При цьому можлива і реакція з озоном:
SO2 + О3 = SO3 + О2
У вологому атмосфері утворюється сірчана кислота.
У насиченій парами води фазі, наприклад, в хмарах, діоксид сірки спочатку утворює сірчистийкислоту, яка з озоном і пероксидом водню дає сірчану кислоту:
Н2SО3- + О3 → SО42- + Н + + О2
НSО3- + Н2О2 → SО42- + Н + + Н 2 О
Реакційний пероксид водню може утворитися з органічних пероксидів у вологому повітрі.
Як діоксид сірки, так і НSО3- в кілька проміжних стадій можуть перетворитися в сірчану кислоту за допомогою іонів металів, які можуть бути присутніми в повітрі, а також в хмарах.
Сірчистий газ з водою повітря утворює крапельки сірчаної кислоти. Розчини сірчаної кислоти можуть довго триматися в повітрі у вигляді плаваючих крапельок туману або випадати разом з дощем на землю. Ці розчини роз'їдають метали, фарби, синтетичні з'єднання, тканини, згубно діють на рослини і тварин. Потрапляючи на землю, сірчана кислота подкисляет грунту. В результаті цього скорочується ґрунтова фауна, що негативно позначається на врожаї.
Вплив на живі організми.
Клас небезпеки речовини - 3.
При підвищеній концентрації пилу токсичну дію діоксиду сірки проявляється значно сильніше, ніж в повітрі, вільному від пилу.
Комбінація діоксиду сірки з оксидами азоту значно збільшує число захворювань дихальних шляхів.
При середньодобової концентрації сірчистого газу 0,1-0,2 мг / м3 у населення спостерігається загострення захворювань верхніх дихальних шляхів. Різке збільшення числа випадків захворюваності на бронхіти у людей старше 55 років відзначається на наступний день після підвищення середньодобової концентрації сірчистого газу до 0,7 мг / м3.
Підвищення рівня забруднення сірчистим газом викликає або хронічне, або гостре короткочасне ураження листя рослин, що призводить до уповільнення росту зеленої маси і зниження врожайності. Руйнується хлорофіл рослин, пошкоджуються листя і хвоя. Уражені ділянки набувають бронзову забарвлення. На листі також з'являються бліді плями, які потім набувають бронзовий колір, потім листя опадає. Найбільш чутливими до діоксиду сірки є хвойні дерева. Сосна гине при середньорічній концентрації сірчистого газу 0,18-0,20 мг / м3. Листяні дерева починають дивуватися при концентрації діоксиду сірки від 0,5 до 1 мг / м3.
Оксиди сірки відчутно прискорюють в містах корозію металів - в 1,5-5 разів у порівнянні з сільською місцевістю. В одному з міст США збільшення концентрації SO2 в 3 рази супроводжувалося збільшенням швидкості корозії цинку в 4 рази.
Особливо небезпечно для рослин високий вміст сірчистого газу, наприклад, при інтенсивному освітленні і великий відносної вологості повітря, а також на стадіях цвітіння і плодоношення. Хронічне пошкодження листя рослин відбувається в результаті поступового накопичення в їх тканинах надлишкової кількості сульфатів. Сульфати також окислюють грунт і знижують її родючість.
Магній.
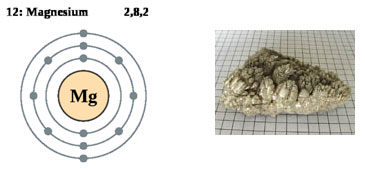
Магній - елемент II групи, в земній корі міститься близько 1,87 масової частки магнію. Магній - характерний елемент мантії Землі. У магматичних процесах магній - аналог заліза.
Міграція в навколишньому середовищі
У біосфері спостерігається енергійна міграція і диференціація магнію: тут головна роль належить фізико-хімічних процесів - розчинення, осадження солей, сорбції магнію глинами. Магній слабо затримується в круговороті речовин на континентах і з річковим стоком надходить в океани. Морська вода не насичена магнієм і осадження його солей не відбувається. При випаровуванні морської води магній знову потрапляє на континенти.
Вплив на живі організми
Магній - постійна і необхідна частина рослинних і тваринних організмів, входить до складу всіх органел клітин. Магній входить до складу хлорофілу рослин, активує багато ферментів живих організмів.
У людському організмі накопичується в печінці, потім переходить в кістки і м'язи. Магній - антагоніст кальцію в організмі, при надлишку магнію, при рахіті він може витісняти кальцій з кісток.
Сполуки магнію відносяться до 3 класу небезпеки по впливу на людей.
"назад"


